
【题目】X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2XO4和HYO4。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是 ( )。
A. 原子半径X>Y B. 氢化物稳定性H2X>HY
C. 原子核内质子数R<M D. 溶液碱性R(OH)2<M(OH)2
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性。充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是

A. 放电时,H+从左槽迁移进右槽
B. 放电过程中,左槽溶液颜色由黄色变为蓝色
C. 充电时,b极接直流电源正极,a极接直流电源负极
D. 充电过程中,a极的电极反应式为:VO2++2H++e- = VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。 为了评价凯库勒的观点,某学生设计了以下实验方案:

实验操作:
①按上图所示的装置图连接好各仪器;
②检验装置的气密性;
③在 A 中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开 K1、K2止水夹,关闭 K3 止水夹;
④待烧瓶 C 中气体收集满后,将导管 b 的下端插入烧杯里的水中,关闭 K2,打开 K3,挤 压预先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题:
(1)实验室可用 MnO2、NaBr 和浓硫酸混合共热制取单质溴,其中 MnO2 作氧化剂。写 出该反应的化学方程式:____。
(2)简述在实验操作步骤②中检验装置气密性的方法:_____________________;在实验过程中观察到装置 A 中有微沸现象,原因是_______________________。
(3)当 C 中观察到____,可证明凯库勒观点是错误的,以下 还可证明凯库勒观点错误的事实是________。
①6 个 C-H 键的长度相等
②6个碳碳键的长度都相等
③苯的一氯代物只有一种结构
④苯的邻二氯代物只有一种结构
⑤苯不能使酸性高锰酸钾溶液褪色
⑥苯不能使溴的四氯化碳溶液因加成而褪色
A.①②⑤⑥ B.②④⑤⑥ C.全部 D.①②③④⑤
(4)查阅文献:苯与液溴在 FeBr3 催化下的反应机理共分三步:
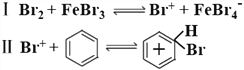
请完成第三步反应:Ⅲ____。
(5)将装置 A 内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯:
①用蒸馏水洗涤,振荡,分液;②用 5%的 NaOH 溶液洗涤,振荡,分液;③用蒸馏水洗 涤,振荡,分液;④加人无水氯化钙干燥;⑤____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关除杂的实验操作合理的是( )
A.除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃
B.除去氧气中少量的氮气:使气体通过炽热的铜粉
C.除去铜粉中少量的碳酸钙:用稀盐酸溶解后过滤
D.除去氯化钠固体中少量的纯碱:加入足量氯化钙溶液,过滤、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化主要反应是煤中碳与水蒸气反应生成CO、H2等。回答下列问题:
(1)CO与H2分别与O2都可以设计成燃料电池。CO与O2设计成燃料电池(以熔融碳酸盐为电解质)负极的电极反应为:______________;
(2)在煤的气化获得的化工原料气中含有少量羰基硫(COS),能引起催化剂中毒、大气污染等。COS的电子式为___________;羰基硫与烧碱溶液反应生成水喝两种正盐的离子方程式为:__________;羰基硫的脱硫常用两种方法,其反应式分别为:
①氢解反应:COS(g) + H2(g) = H2S(g) + CO(g) ΔH1=+7kJ/mol
②水解反应:COS(g) + H2O(g) = H2S(g) + CO2(g) ΔH2
已知反应中相关的化学键键能数据如下:
化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
则ΔH2=____________kJ/mol。
(3)脱硫处理后的CO和H2在催化剂作用下合成甲醇:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=-90.14kJ/mol。该反应能自发的理由是_______
CH3OH(g)+H2O(g) ΔH2=-90.14kJ/mol。该反应能自发的理由是_______
①一定温度下,在两个容积都为为VL的恒容莫比容器中,按如下方式加入反应物,一段时间后达到平衡:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、3a molH2、 n molCH3OH(g)、n molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则n的取值范围为_____________;
②甲容器保持恒容,欲增大H2的平衡转化率,可采取的措施有:________(答两点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.常温常压下,22.4 L CCl4、CO2含有的分子数为1NA
B.常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02NA
C.通常状况下,NA个CO2分子占有的体积约为22.4 L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com