
(1)在烧瓶中加入乙醇、乙酸和浓硫酸外,还应加入___________,目的是___________。
(2)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗中边滴加乙酸边加热蒸馏。这样操作可以提高酯的产率,其原因是:_________________________。
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,分离操作步骤流程如下:
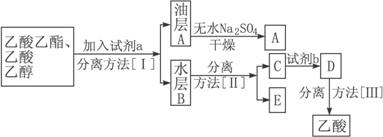
则试剂a是____________________________________,分离方法[Ⅰ]是___________;分离方法[Ⅱ]是____________________________。
试剂b是_________________,分离方法[Ⅲ]是___________________________。
(4)甲、乙两位同学欲将所得的含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来,甲、乙两人实验结果如下:
甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质。丙同学分析了上述实验目标产物后,认为上述实验没有成功。
试回答下列问题:
甲失败的原因是______________________________________________________。
乙失败的原因是______________________________________________________。
解析:(1)对液体混合物加热时,一定要防止溶液爆沸,所以往往要加入沸石或碎瓷片,以防发生爆沸。
(2)乙酸乙酯的制备反应是可逆反应,为提高反应物的转化率和提高产率,通常采取增大某反应物的浓度或减小生产物的浓度的方法。通过分液漏斗中边滴加乙酸边加热蒸馏,可以不断增大乙酸的浓度,减小乙酸乙酯的浓度,最终实现产率的提高。
(3)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可。对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇。然后水层中的乙酸钠要用盐酸反应得到乙酸,再蒸馏得到乙酸。
(4)NaOH不仅与乙酸反应,而且过量时与乙酸乙酯反应使酯水解得到大量乙酸钠和乙醇。若NaOH不足时,混合物中的乙酸将无法除净。
答案:(1)沸石或碎瓷片,以防发生爆沸
(2)乙酸乙酯的制备反应是可逆反应,通过分液漏斗中边滴加乙酸边加热蒸馏,可以不断增大乙酸的浓度,减小乙酸乙酯的浓度,最终实现产率的提高
(3)饱和Na2CO3溶液,分液,蒸馏,稀盐酸,蒸馏
(4)NaOH不足,导致乙酸除不净;NaOH过量导致乙酸乙酯发生大量水解


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
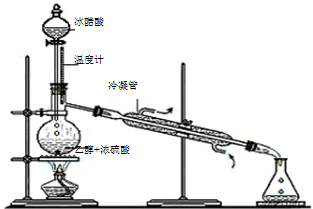
 实验室合成乙酸乙酯的步骤如下:在园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
实验室合成乙酸乙酯的步骤如下:在园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 有机化学知识在生活中应用广泛.
有机化学知识在生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
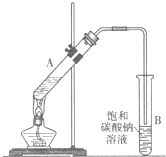 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
| 浓硫酸 |
| ℃140 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com