

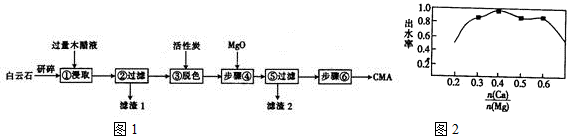
| 水/硝酸钙 | 0.8:1 | 0.9:1 | 0.95:1 | 1:1 | 1.05:1 | 1.1:1 | 1.15:1 |
| 浸出率/% | 83.1 | 94.5 | 98.2 | 99.1 | 99.5 | 99.6 | 99.7 |
分析 (1)硝酸尾气吸收法是利用碱溶液吸收汽车尾气,有利于对尾气进行回收利用,减小大气污染;
(2)①洗涤液中碳酸钠和硫酸钠与硝酸钙发生复分解反应,生成难溶的碳酸钙和硫酸钙;
②为减少硝酸的浪费,所以的硝酸盐呈中性,所以应加硝酸调节溶液呈中性;可通过提高硝酸浓度、增加接触面积和升高反应液的温度来加快化学反应速率;
③由表可知水的比重越小,浸出率越低,水的比重越大浸出率越高,但加水多后续蒸发要消耗大量的热能;
(3)用硝酸钠、木炭、硫磺也可以制得威力巨大的火药,爆炸时产生一种单质是氮气,一种氧化物是二氧化碳以及Na2S,其中,除硝酸钠之外,另外一种氧化剂硫和还原剂碳的物质的量之比为1:3,所以方程式为:2NaNO3+S+3C=Na2S+N2↑+3CO2↑;
(4)KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+,所以发生反应为:2KMnO4~~~5NaNO2,由此分析解答.
解答 解:(1)硝酸尾气吸收法是利用碱溶液吸收汽车尾气,有利于对尾气进行回收利用,减小大气污染,故答案为:对尾气进行回收利用,减小污染;
(2)①洗涤液中碳酸钠和硫酸钠与硝酸钙发生复分解反应,生成难溶的碳酸钙和硫酸钙,反应方程式为:Ca(NO3)2+Na2SO4=CaSO4↓+2NaNO3,Na2CO3+Ca(NO3)2=CaCO3↓+2NaNO3,故答案为:Ca(NO3)2+Na2SO4=CaSO4↓+2NaNO3;Na2CO3+Ca(NO3)2=CaCO3↓+2NaNO3;
②为减少硝酸的浪费,所以的硝酸盐呈中性,所以应加硝酸调节溶液呈中性,所以调节pH=7;可通过提高硝酸浓度、增加接触面积和升高反应液的温度来加快化学反应速率,则可以搅拌、适当升高温度,故答案为:7;可以搅拌、适当升高温度;
③由表可知水的比重越小,浸出率越低,水的比重越大浸出率越高,但加水多后续蒸发要消耗大量的热能,故答案为:加水太少,硝酸钠浸出率低;加水太多,蒸发结晶时耗费太多能源,导致成本提高;
(3)用硝酸钠、木炭、硫磺也可以制得威力巨大的火药,爆炸时产生一种单质是氮气,一种氧化物是二氧化碳以及Na2S,其中,除硝酸钠之外,另外一种氧化剂硫和还原剂碳的物质的量之比为1:3,所以方程式为:2NaNO3+S+3C=Na2S+N2↑+3CO2↑,故答案为:2NaNO3+S+3C=Na2S+N2↑+3CO2↑;
(4)KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+,所以发生反应为:
2KMnO4 ~~~~~~~5NaNO2,
2 5
0.l000mol/L×19.50×10-3L n(NaNO2)
n(NaNO2)=$\frac{0.l000mol/L×19.50×1{0}^{-3}L×5}{2}$=0.004875mol,则粗产品中亚硝酸钠的质量百分含量为$\frac{0.004875mol×69g/mol×\frac{l00.00mL}{25.00mL}}{2.000g}×100%$=67.27%,
故答案为:67.27%.
点评 本题考查尾气处理、方程式的书写和氧化还原的计算,综合性强,特别(4)中的计算,学生要列出关系式进行求解是解题的关键,有一定的难度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝片跟氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| B. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 硫酸氢钠与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧的铁丝在氯气中燃烧,集气瓶内充满棕黄色烟雾 | |
| B. | 氢气在氯气中燃烧,集气瓶口有白雾 | |
| C. | 向盛水的烧杯中先加入过氧化钠,再滴加酚酞,最终溶液呈红色 | |
| D. | 将一块钠放在燃烧匙中加热,燃烧后得到白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
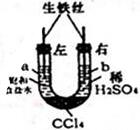 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )
利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )| A. | a管发生吸氧腐蚀,b管发生析氢腐蚀 | |
| B. | 一段时间后,a管液面高于b管液面 | |
| C. | a处、b处溶液的pH都增大 | |
| D. | a、b两处具有相同的电极反应式:Fe-3e-═Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com