
已知:常温下,0.01 mol·L-1 MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为 ( )
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.69.4 kJ·mol-1 D.45.2 kJ·mol-1
科目:高中化学 来源: 题型:
x、y、z、w是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊,是由其中的两种或三种元素组成的化合物。己是由z元素形成的单质。已知,甲+乙=丁+己,甲+丙=戊+己,0.1mol·L-1丁溶液的pH为13(25℃)下列说法正确的是
A.1mol甲与足量的乙完全反应共转移1mol电子
B.y元素在周期表位置为第三周期IVA族
C.原子半径w大于z大于y大于x
D.1.0L 0.1mol·L-1戊溶液中阴离子总物质的量小于0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
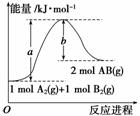
查看答案和解析>>
科目:高中化学 来源: 题型:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2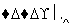 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2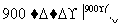 mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是 ( )
 A.该过程中CeO2没有消耗
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
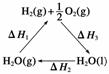
C.右图中ΔH1=ΔH2+ΔH3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-===CO +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:
CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH=49.0 kJ·mol-1
下列说法正确的是 ( )
A.1 L CH3OH蒸气与1 L水蒸气反应生成1 L CO2气体与3 L氢气吸收热量49.0 kJ
B.1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ热量
C.相同条件下1 mol CH3OH(g)与1 mol H2O(g)的能量总和小于1 mol CO2(g)与3 mol H2(g)的能量总和
D.1 mol CH3OH蒸气与1 mol液态水反应生成1 mol CO2气体与3 mol氢气吸收的热量小于49.0 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
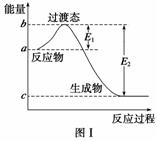

(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:________________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH=49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g)
O2(g)===CO2(g)+2H2(g)
ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为________________________________________________________________________。
(3)下表是部分化学键的键能参数:
| 化学键 | P—P | P—O | O===O | P===O |
| 键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=________ kJ·mol-1(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下烃中,一氯代物只有一种的是 ( )
A.CH3 CH2 CH2 CH2CH3 B.CH3CH2CH3 C. CH3CH2CH2CH3 D.C(CH3)4
查看答案和解析>>
科目:高中化学 来源: 题型:
某炔烃经催化加氢后,得到2-甲基丁烷,该炔烃是( )
A.2-甲基-1-丁炔 B.2-甲基-3-丁炔 C.3-甲基-1-丁炔 D.3-甲基-2-丁炔
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com