
【题目】下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )
A.CuCl2
B.FeCl2
C.FeCl3
D.AlCl3
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】有机合成中碳环的形成非常重要。
(1)重氮甲烷(![]() )在加热或光照时分解成碳烯(∶CH2):
)在加热或光照时分解成碳烯(∶CH2):![]() 。碳烯与烯烃反应,生成含有三元环的环状化合物,如:
。碳烯与烯烃反应,生成含有三元环的环状化合物,如: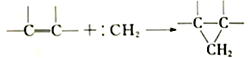 。则根据反应
。则根据反应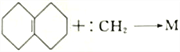 ,回答下列问题:
,回答下列问题:
①写出M 的结构简式:__________________。
②上述反应的反应类型是____________________。
③1mol M在氧气中完全燃烧,最多能消耗________mol O2。
④下列有关![]() 的说法正确的是____________
的说法正确的是____________
a.能使酸性KMnO4溶液褪色 b.核磁共振氢谱有四组吸收峰 c.属于烯烃
(2)1928年,狄尔斯和阿尔德在研究1,3-丁二烯的性质时发现如下反应: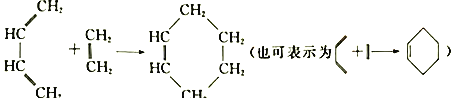 ,这种反应被称为狄尔斯一阿尔德(Diels-Alder)反应。据此回答下列问题:
,这种反应被称为狄尔斯一阿尔德(Diels-Alder)反应。据此回答下列问题:
①现有反应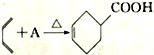 ,则物质A的结构简式为___________________。
,则物质A的结构简式为___________________。
②物质 与物质
与物质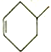 发生“Diels- Alder反应”的生成物为______________________。
发生“Diels- Alder反应”的生成物为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下可合成甲醇。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1) △H1=-Q1kJ·mol-1
②2CO(g)+O2(g)=2CO2 (g) △H2=-Q2kJ·mol-1
③H2O(g)=H2O(1) △H3=-Q3kJ·mol-1
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:_____________。
(2)合成甲醇发生的反应如下
①CO(g)+2H2(g) ![]() CH3OH(g) △H1=-a kJ·mol-1
CH3OH(g) △H1=-a kJ·mol-1
②CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) △H2=-b kJ·mol-1
CH3OH(g) +H2O(g) △H2=-b kJ·mol-1
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H3=+c kJ·mol-1
CO(g)+H2O(g) △H3=+c kJ·mol-1
I:在以上制备甲醇的两个反应中,反应①优于反应②,原因为_____________。
Ⅱ:合成气的组成![]() 时体系中的CO平衡转化率(a)与温度和压强的关系如图所示。
时体系中的CO平衡转化率(a)与温度和压强的关系如图所示。
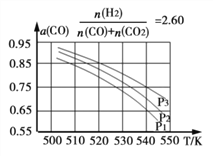
①a(CO)值随温度升高而_____________(填“增大”或“减小”),其原因是_____________
②图中的压强由大到小为_____________,其判断理由是_____________
(3)通常合成甲醇的主要反应为:CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
①在一定温度下,上述反应在一密闭容器中达到平衡,在保证H2浓度不变的情况下,增大容器的体积,平衡_____________(填字母);作出此判断的理由是_____________。
a.向正反应方向移动 b.向逆反应方向移动 c.不移动
②某温度下,将1 mol CO和4molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol·L-1,则H2的转化率为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘单质,成熟的工艺流程如下。
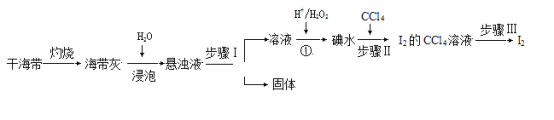
回答下列问题:
(1)实验室灼烧干海带通常在_____________中进行(填仪器名称)。
(2)步骤Ⅰ名称是____________,步骤Ⅲ名称是___________。
(3)验证反应①已经发生的实验操作是______________________________________________________。
(4)步骤Ⅱ中的CCl4能否改为乙醇,解释原因________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品安全已成为近几年来社会关注的热点问题之一。下列有关食品添加剂使用的说法正确的是
A. 为了防止食品腐败,加入适量苯甲酸钠以达到阻抑细菌繁殖的作用
B. 为了提高奶粉中的氮含量,加入适量的三聚氰胺
C. 为了调节食品色泽,改善食品外观,使用工业色素苏丹红
D. 食盐是咸味剂,无防腐作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下表所示。X元素最常见价态氢化物与其最高价氧化物对应的水化物反应可以生成一种离子化合物。下列说法正确的是
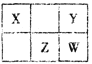
A. 简单离子半径:W>Z>Y
B. 简单气态氢化物的稳定性:Y >Z > W
C. 最高价氧化物对应的水化物酸性:W >Z
D. 若W的最高正价为+ m,则Y的最高正价也一定为+m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使城市生活垃圾得到合理利用,减少垃圾的填埋量,近年来步实施了生活垃圾分类投放的办法。其中废旧塑料袋、废旧报纸和纸箱、废旧衣物等属于
A. 纯净物 B. 氧化物 C. 有机物 D. 非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑白(Sb2O3)在工业中有着广泛的作用。用辉锑矿(主要成分为Sb2S3,还含有少量 SiO2)制备锑白的工艺流程如下图:
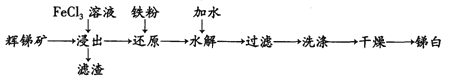
已知:
①Sb3+与Fe2+的氧化性强弱相当。
②Sb2S3不溶于水;Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
③水解时保持溶液的c(H+) =0.1~0.3mol/L。
(1) “浸出”是将辉锑矿溶于FeCl3溶液,为提高浸出速率可采取的措施是_________(任写一种)。请写出其中发生的氧化还原反应离子方程式: _________。滤渣的成分为S单质和_________。
(2) 水解是利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分为多步),其反应可以简单表示为:SbCl3 +3H2O![]() Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________。
Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________。
(3) 简述检验沉淀是否洗净的实验方法: _________,若未出现浑浊则证明沉淀己洗干净,反之则没有。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com