
【题目】(1)下列Li原子电子排布图表示的状态中,电离最外层一个电子所需能量最小的是_______(填标号)。
A.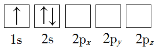 B.
B.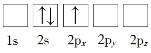
C.![]() D.
D.![]()
(2)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为______;推测抗坏血酸在水中的溶解性:_______(填“难溶于水”或“易溶于水”)。

(3)下表列有三种物质(晶体)的熔点:
物质 | SiO2 | SiCl4 | SiF4 |
熔点℃ | 1710 | -70.4 | -90.2 |
简要解释熔点产生差异的原因:_______。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其晶胞,晶胞边长为anm。则硼原子与磷原子最近的距离为_______。用Mg·mol-1表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度为_______g·cm-3。
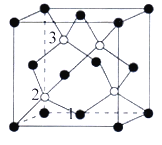
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(![]() ,
,![]() ,0),则原子2和3的坐标分别为_______、______。
,0),则原子2和3的坐标分别为_______、______。
【答案】D sp3、sp2 易溶于水 SiO2是原子晶体,微粒间作用力为共价键。SiCl4是分子晶体,微粒间作用力为范德华力,故SiO2熔点高于SiCl4和SiF4。SiCl4和SiF4均为分子晶体,微粒间作用力为范德华力,结构相似时相对分子质量越大,范德华力越大,故SiCl4熔点高于SiF4 ![]() nm
nm 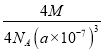 (
(![]() ,
,![]() ,
,![]() ) (
) (![]() ,
,![]() ,
,![]() )
)
【解析】
(1)原子核外电子排布中,如果电子所占的轨道能级越低,该原子的能量越低;
(2)根据分子中C原子的价层电子对个数,结合价层电子对互斥理论判断该分子中C原子轨道杂化类型;抗坏血酸中羟基属于亲水基,增大其水解性;
(3)根据构成微粒的作用力大小分析、比较;
(4)晶体中硼原子与磷原子最近的距离为晶胞体对角线的![]() ,根据晶体密度与摩尔质量换算关系计算
,根据晶体密度与摩尔质量换算关系计算![]() ;根据图中各个原子的相对位置确定2、3号原子的坐标。
;根据图中各个原子的相对位置确定2、3号原子的坐标。
(1)原子核外电子排布中,如果电子所占的轨道能级越低,该原子的能量越低。根据图知,电子排布能量最低的是1s、2s能级,所以合理选项是D;
(2) 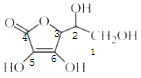 中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型,1、2、3号C原子采用sp3杂化,4、5、6号C原子采用sp2杂化;抗坏血酸中羟基属于亲水基,增大其水解性,所以抗坏血酸易溶于水;
中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型,1、2、3号C原子采用sp3杂化,4、5、6号C原子采用sp2杂化;抗坏血酸中羟基属于亲水基,增大其水解性,所以抗坏血酸易溶于水;
(3)SiO2是原子晶体,原子间以极强的共价键结合,断裂消耗很高的能量,而SiCl4、SiF4都是由分子通过分子间作用力结合形成的分子晶体,分子间作用力非常微弱,所以SiO2熔点高于SiCl4和SiF4。对于由分子构成的分子晶体,若物质结构相似,相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,所以SiCl4熔点高于SiF4;
(4)BP晶体中晶胞参数是anm,晶胞的对角线长度为L=![]() ,根据晶胞结构可知:在晶体中硼原子与磷原子晶胞体对角线的
,根据晶胞结构可知:在晶体中硼原子与磷原子晶胞体对角线的![]() ,因此二者的最近的距离为
,因此二者的最近的距离为![]() nm。在一个晶胞中含有B、P原子个数为P:
nm。在一个晶胞中含有B、P原子个数为P:![]() =4;含有的B原子数目为4个,所以一个晶胞中含有4个BP,用Mg·mol-1表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度
=4;含有的B原子数目为4个,所以一个晶胞中含有4个BP,用Mg·mol-1表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度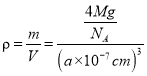 =
=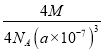 g/cm3
g/cm3![]() ,
,![]() ,0),则原子2的坐标为(
,0),则原子2的坐标为(![]() ,
,![]() ,
,![]() ),原子3的坐标为(
),原子3的坐标为(![]() ,
,![]() ,
,![]() )。
)。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】将纯铁片和纯铜片按下图所示插入同浓度的稀硫酸中一段时间,下列叙述正确的是
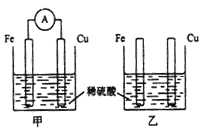
A. 甲装置中电能转化为化学能
B. 两个装置中铜片表面均有气泡产生
C. 甲装置中H+移向铜片发生还原反应
D. 甲中负极上发生的电极反应为Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)
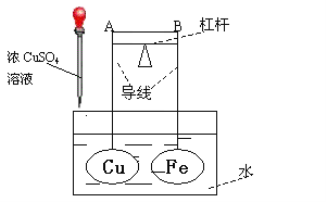
A.杠杆为导体或绝缘体时,均为A端低B端高
B.杠杆为导体A端高B端低;杠杆为绝缘体时,AB保持水平
C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH![]() C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
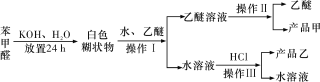
根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活、工业生产往往产生大量含碳、氮、硫的废弃气体,合理再利用或转化上述气体,变废为宝成为人们共同关注的课题。
I.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=_______(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=_______(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_______。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_______。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。
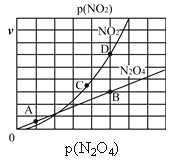
(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是________。
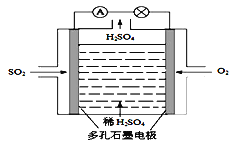
II.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(4)原电池原理:该小组设计的原理示意图如图,写出该电池负极的电极反应式_____。
(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式_________。

(6)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为______(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是一种香料的成分之一,其结构中含有三个六元环。G的结构简式为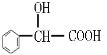 ,H的合成路线如图(部分产物和反应条件略去):
,H的合成路线如图(部分产物和反应条件略去):
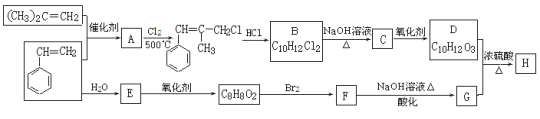
已知:①B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
②RCH=CH2+CH2=CHR’![]() CH2=CH2+RCH=CHR’
CH2=CH2+RCH=CHR’
③D和G是同系物
(1)用系统命名法命名(CH3)2C=CH2____________。
(2)A→B反应过程中涉及的反应类型有________。
(3)G分子中含氧官能团的名称:________。
(4)写出生成F的化学方程式_____________。
(5)写出C的结构简式:________。
(6)同时满足下列3个条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的G的同分异构体有________种(不包括立体异构),其中核磁共振氢谱为4组峰的为________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶1和1∶1分别形成两种化合物甲和乙。D、A按原子个数比3∶2形成化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是___________________________。
(2)A、B、C、D、E五种元素的原子半径由大到小的顺序是(用元素符号填写)_______________。
(3)写出E的最高价氧化物对应的水化物分别与A、C两元素的最高价氧化物对应的水化物反应的离子方程式:①_____________________________________;
_____________________________________。
(4)D、A按原子个数比3∶2形成化合物丙的化学式为____________。
(5)C、B可按原子个数比1∶1形成化合物乙的电子式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Ⅰ是有机合成中的一种重要中间体,具体合成过程如下(部分产物及条件略去):

①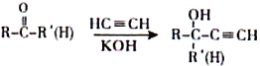
②
③![]()
④化合物A的一氯代物只有一种
(1)G分子中含有的官能团名称为___________。
(2)A→B的反应类型为________,G→H的反应类型为______。
(3)D的化学名称为_________。
(4)C的结构简式为______,L的结构简式为____。
(5)G→J中过程①的化学方程式为_______。
(6)同时满足下列条件的I的同分异构体有____种(不考虑立体异构,不包括I)。①与具有相同的官能团②具有六元碳环结构③分子中有一个甲基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是______。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______(用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____。(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com