
钠在空气中长期露置,最终变成( )
A.Na2O B.Na2O2 C.Na2CO3 D.NaOH
考点:钠的化学性质.
分析:根据钠长期暴露在空气中,发生的一系列变化:切开金属钠置于空气中,切口开始呈银白色→变暗→变白色固体→成液→结块→最后变成Na2CO3粉末.
解答: 解:切开金属钠置于空气中,切口开始呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3•10H2O)→最后变成Na2CO3粉(风化),有关反应如下:4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO3•10H2O、Na2CO3•10H2O=Na2CO3+10H2O,
故选C.
点评:金属钠暴露在空气中发生的现象体现了钠及其化合物的性质,根据钠及其化合物的性质可以解释发生的现象.


科目:高中化学 来源: 题型:
(1)现有下列状态的物质①干冰 ②NaCl晶体 ③氨水 ④醋酸 ⑤酒精水溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖,其中属于电解质的是 (填序号),属于非电解质的是 (填序号),能导电的是 (填序号).
(2)某有色电解质溶液中,可能大量存在有Ag+、H+、Cu2+、OH﹣、Cl﹣等离子,你认为:一定有的离子是 ,一定没有的离子是 ,不能确定的离子 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在1.01KPa和298K条件下,2molH2生成水蒸汽放出484kJ热量,下列热化学方程式正确的是( )
A. 2H2(g)+O2(g)=2H2O(l);△H=﹣484kJ/mol
B. H2O(g)=H2(g)+ O2(g);△H=﹣242kJ/mol
O2(g);△H=﹣242kJ/mol
C. 2H2(g)+O2(g)=2H2O(g);△H=+484kJ/mol
D. H2(g)+ O2(g)=H2O(g);△H=﹣242kJ/mol
O2(g)=H2O(g);△H=﹣242kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
选项 叙述Ⅰ 叙述Ⅱ
A Cl2具有漂白性 Cl2能使干燥的有色布条褪色
B F元素非金属性很强 HF是一种强酸
C 浓H2SO4有强氧化性,SO2具有较强的还原性 但浓H2SO4却能干燥SO2
D 乙醇能杀菌消毒 医药上选用纯酒精进行消毒
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
近年以来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
 活性炭 NO E F
活性炭 NO E F
T1 2.000 0.040 0.030 0.030
T2 2.005 0.050 0.025 0.025
①请结合上表数据,写出NO与活性炭反应的化学方程式 .
②上述反应的平衡常数表达式K= ,根据上述信息判断,T1和T2的关系是 .
A.T1>T2B.T1<T2C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是 .
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示
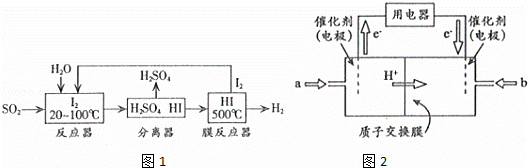
①用离子方程式表示反应器中发生的反应: .
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 .
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示
通过a气体的电极是原电池的 极(填“正”或“负”),b电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式错误的是( )
A.CaCl2=Ca2++2Cl﹣ B.Na2SO4=2Na++SO42﹣
C.HNO3=H++NO3﹣ D.KClO3=K++Cl﹣+3O2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组在家中进行化学实验,按照图甲连接好线路后发现灯泡不亮,按照图乙连接好线路后发现灯泡亮,由此得出的结论正确的是( )

A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl是弱电解质
D.NaCl在水溶液中电离出了可以自由移动的离子
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
|
| A. | 分散质颗粒直径都在l~100nm之间 |
|
| B. | 能透过半透膜 |
|
| C. | 加热蒸干、灼烧后都有氧化铁生成 |
|
| D. | 呈红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为5L的密闭容器中,通入5mol N2和8mol H2,在一定条件下反应生成NH3,当反应进行到2min时,测得容器内有4mol NH3.则:
(1)2min时,容器内n(N2)= ,c(H2)= .
(2)2min内,以N2表示的平均反应速率v(N2)= .
(3)2min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com