
| ||
| n |
| V |
| 15.9g |
| 106g/mol |
| ||
| 0.15mol×2 |
| 0.5L |


科目:高中化学 来源: 题型:
| A、常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 |
| B、向AgCl的悬浊液中加入0.1 mol?L-1KI溶液,沉淀可由白色转化为黄色 |
| C、将0.001 mol?L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 |
| D、向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有共价键的化合物必是共价化合物 |
| B、阴、阳离子间通过静电引力所形成的化学键是离子键 |
| C、液态氯化氢中存在H+和Cl-,所以能导电 |
| D、化学变化过程,一定会破坏旧的化学键,同时形成新的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LCHCl3的分子数0.1NA |
| B、1molNH3中含有3NA对电子 |
| C、9.2g NO2和N2O4的混合气中含有的氮原子数为大于0.2NA |
| D、某氯化铁溶液中Fe3+的数目为NA,则Cl-的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、35和37表示的是质量数 |
| B、35Cl和37Cl互称为同素异形体 |
| C、O2和O3是氧元素的两种同位素 |
| D、1H216O和2H218O的相对分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+、Fe3+、Cl-、SO42- |
| B、Mg2+、Al3+、Cl-、SO42- |
| C、NH4+、OH-、Cl-、H+ |
| D、Ba2+、H+、SiO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg| c(H+) |
| c(OH-) |
| A、A点时加入氢氧化钠溶液体积为20 mL |
| B、室温时0.01 mol?L-1的醋酸溶液pH=4 |
| C、OA段溶液中:c(CH3COO-)>c(CH3COOH) |
| D、若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
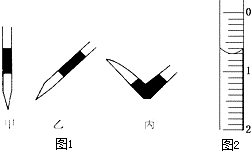 使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.
使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.滴定次数 实验数据/mL | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.80 | 15.00 | 15.02 | 14.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com