
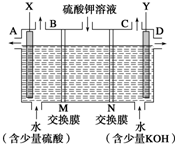
 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.分析 (1)(2)目的是用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾,由装置图可知,硫酸应在左室得到,KOH在右室得到,左室为阳极室,氢氧根离子放电生成氧气,M为阴离子交换膜,硫酸根离子通过阴离子交换膜进入左室,右室为阴极室,氢离子放电生成氢气,N为阳离子交换膜,钾离子通过阳离子交换膜进入右室;
(3)将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),负极发生氧化反应,氢气再负极失去电子,碱性条件下生成水;
(4)计算氢气物质的量,根据H元素化合价变化计算转移电子,由电子转移守恒可知,左室发生反应:2H2O-4e-=O2↑+4H+,根据电子转移守恒计算H+的物质的量,进而计算算硫酸质量.
解答 解:目的是用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾,由装置图可知,硫酸应在左室得到,KOH在右室得到,左室为阳极室,氢氧根离子放电生成氧气,M为阴离子交换膜,硫酸根离子通过阴离子交换膜进入左室,右室为阴极室,氢离子放电生成氢气,N为阳离子交换膜,钾离子通过阳离子交换膜进入右室.
(1)X为阳极,连接电源的正极,右室生成氢气,从C口导出,
故答案为:正;C;
(2)由上述分析可知,M为阴离子交换膜,
故答案为:阴离子;
(3)将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),负极发生氧化反应,氢气再负极失去电子,碱性条件下生成水,负极电极反应式为:H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O;
(4)生成氢气物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,转移电子为0.5mol×2=1mol,转移电子数目为6.02×1023,左室发生反应:2H2O-4e-=O2↑+4H+,生成氢离子为1mol,则得到硫酸为$\frac{1mol}{2}$=0.5mol,故得到硫酸质量为0.5mol×98g/mol=49g,
故答案为:49;6.02×1023.
点评 本题考查电解原理应用及有关计算,关键是根据装置图与电解原理判断阳极与阴极,理解掌握离子放电顺序,掌握电化学计算中电子转移守恒应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) 2SO3(g);3Fe
2SO3(g);3Fe (s)+4H2O(g)
(s)+4H2O(g) Fe3O
Fe3O 4(g)+4H2(
4(g)+4H2( g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处。请填写以下空白:
g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处。请填写以下空白:
(1)若x=1.5,则左侧反应在起始时向__________(填“正”或“逆”)反应方向进行。欲使反应维持向该方向进行,则x的取值范围是______________。
(2)若x=2,平衡时混合气中SO2所占的体积分 数为______________。欲使起始反应维持向该方向进行,则x的最大值应小于____________。
数为______________。欲使起始反应维持向该方向进行,则x的最大值应小于____________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,5.2g乙炔和苯的混合气体中含有的碳原子数为0.4NA | |
| B. | 标准状况下,2.24L氖气所含原子数为0.2NA | |
| C. | 1mol硫酸氢钠固体中含阳离子总数2 NA | |
| D. | 5.6g Fe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可大大提高生产效率 | |
| B. | 由反应需在300℃进行,可知该反应是吸热反应 | |
| C. | 增大原料气中CO2的百分含量,可以提高H2的转化率 | |
| D. | 70MPa的压力,不仅可以增加单位时间内的产出,还可以提高CO2和H2的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
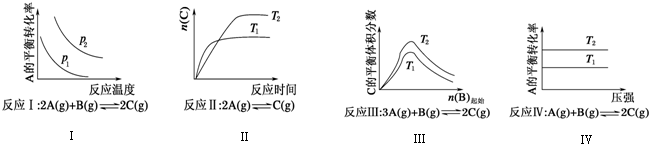
| A. | 反应Ⅰ:△H>0,p2>p1 | B. | 反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1 | ||
| C. | 反应Ⅱ:△H>0,T1>T2 | D. | 反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时体积V(A)=V(B)=a L,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)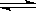 Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
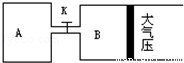
(1)B中X的转化率α(X)B为_________。
(2)A中W和B中Z的物质的量的比较:n(W)A __________________ n(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为_________升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容 器恢复原来反应前的体积,可采取的措施是____________________。
器恢复原来反应前的体积,可采取的措施是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||
| B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
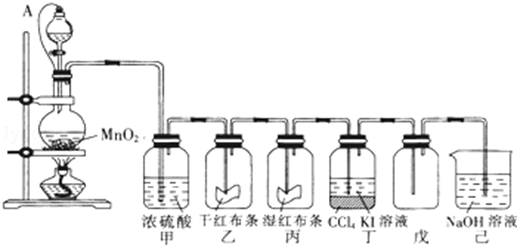
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com