
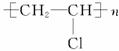
图2-2-3
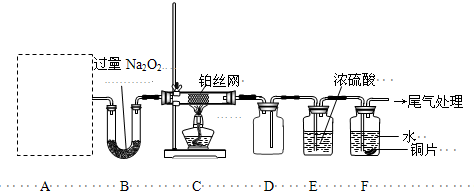
(1)在实验室中收集气体B的方法是_____________________________________________。
(2)操作①的名称是_________。在操作①中所使用的玻璃仪器的名称是_________。
(3)写出反应②和反应③的化学方程式:
反应②:______________________________________________________
反应③:______________________________________________________
(4)A的化学式是________________________________________________。
(5)在实验室中,如要获得干燥纯净的气体D,可以将它通过如图2-2-4中的装置,其中瓶Ⅰ中盛放的试剂是_________;瓶Ⅱ中盛放的试剂是_________;收集干燥气体D的方法是___________________________________________________________________。
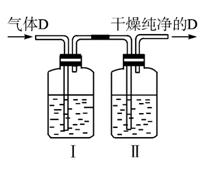
图2-2-4
解析:由框图上部从左向右,可知B是C2H2,与HCl加成反应生成CH2=CHCl,然后加聚得到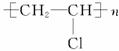 ,即合成树脂,联想到实验室制乙炔的反应,可知A为CaC2,得到的悬浊液为石灰乳,经操作①(过滤),得白色沉淀Ca(OH)2和无色溶液澄清石灰水,然后经反应②生成白色固体CaCO3,再与稀盐酸反应生成无色溶液CaCl2和无色气体D(CO2)。框图最下面的分支中,澄清石灰水与CO2反应生成悬浊液CaCO3,再与CO2反应,得无色溶液?Ca(HCO3)2,?然后两种无色溶液发生反应③,即Ca(OH)2和Ca(HCO3)2反应生成CaCO3沉淀。本题将CaC2制乙炔以及Ca(OH)2与CO2发生的一系列反应有机地结合起来,综合考查这部分知识,试题设计周密合理,平衡有序。如果能敏捷地观察到C2H2
,即合成树脂,联想到实验室制乙炔的反应,可知A为CaC2,得到的悬浊液为石灰乳,经操作①(过滤),得白色沉淀Ca(OH)2和无色溶液澄清石灰水,然后经反应②生成白色固体CaCO3,再与稀盐酸反应生成无色溶液CaCl2和无色气体D(CO2)。框图最下面的分支中,澄清石灰水与CO2反应生成悬浊液CaCO3,再与CO2反应,得无色溶液?Ca(HCO3)2,?然后两种无色溶液发生反应③,即Ca(OH)2和Ca(HCO3)2反应生成CaCO3沉淀。本题将CaC2制乙炔以及Ca(OH)2与CO2发生的一系列反应有机地结合起来,综合考查这部分知识,试题设计周密合理,平衡有序。如果能敏捷地观察到C2H2![]() C2H3Cl
C2H3Cl![]() (C2H3Cl)n的变化,失误应该不会太多,是一个比较平稳的好题。
(C2H3Cl)n的变化,失误应该不会太多,是一个比较平稳的好题。
答案:(1)排水集气 (2)过滤 漏斗、玻璃棒、烧杯
(3)Ca(OH)2+CO2====CaCO3↓+H2O
Ca(OH)2+Ca(HCO3)2====2CaCO3↓+2H2O
(4)CaCl2
(5)饱和碳酸氢钠溶液(答水也可) 浓硫酸 向上排空气法(其他合理答案也可)


科目:高中化学 来源: 题型:阅读理解
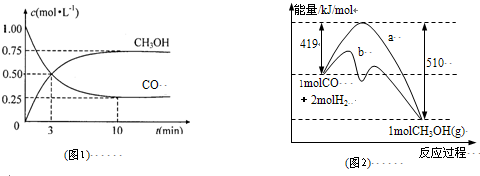
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验方法 | 实验现象 | 结 论 |
| 分别向A、B溶液中加 KSCN溶液 |
固体物质中有FeCl3 | |
| 分别向KMnO4溶液中 加适量A、B溶液 |
KMnO4溶液颜色无明显变化 | 固体物质中不含 |
| 氢氧化物 开始沉淀时的pH |
氢氧化物 沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu | ||
查看答案和解析>>
科目:高中化学 来源:2013届黑龙江省哈尔滨九中高三第四次(12月)月考化学试卷(带解析) 题型:填空题
(11分)下图物质A~K均由a、b、c、d、e、f五种元素组成。a、b、c、d、e、f为原子序数依次增大的短周期元素;由a、b、c、d四种元素形成酸式盐A;b的最外层电子数是电子层数的2倍;由d、e元素可形成两种离子化合物,且阳离子与阴离子的个数比都为2 : 1,其中一种为X;B、C、D为常见的气体;F为白色胶状物质。(部分产物未列出)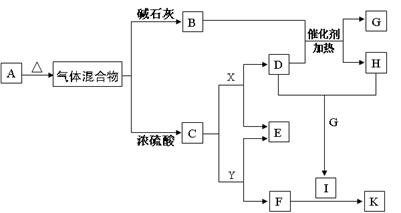
(1)物质A的化学式_______________
(2)Y的溶液呈 性(填“酸性” 、“碱性” 或“中性”),用离子反应方程式解释原因:
(3)将溶液K蒸干灼烧,得到的固体产物为 ,此固体产物的用途是 (答出一条即可)
(4)B与H在一定条件下反应生成c单质和G,反应中氧化产物与还原产物物质的量之比为
(5)常温下,向0.1mol/L的K溶液中加入Na2O2,加入Na2O2的质量与产生沉淀的质量具有如图所示关系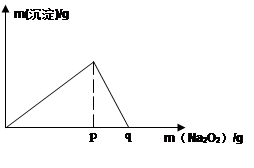
①当溶液pH= ,开始生成沉淀(已知生成沉淀的Ksp=1×10-31 )
②p点时产生沉淀与放出气体的物质的量之比为
③从开始加Na2O2固体至q点的整个过程中,总反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三第四次(12月)月考化学试卷(解析版) 题型:填空题
(11分)下图物质A~K均由a、b、c、d、e、f五种元素组成。a、b、c、d、e、f为原子序数依次增大的短周期元素;由a、b、c、d四种元素形成酸式盐A;b的最外层电子数是电子层数的2倍;由d、e元素可形成两种离子化合物,且阳离子与阴离子的个数比都为2 : 1,其中一种为X;B、C、D为常见的气体;F为白色胶状物质。(部分产物未列出)

(1)物质A的化学式_______________
(2)Y的溶液呈 性(填“酸性” 、“碱性” 或“中性”),用离子反应方程式解释原因:
(3)将溶液K蒸干灼烧,得到的固体产物为 ,此固体产物的用途是 (答出一条即可)
(4)B与H在一定条件下反应生成c单质和G,反应中氧化产物与还原产物物质的量之比为
(5)常温下,向0.1mol/L的K溶液中加入Na2O2,加入Na2O2的质量与产生沉淀的质量具有如图所示关系
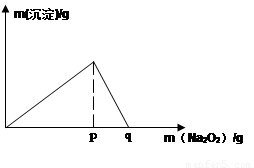
①当溶液pH= ,开始生成沉淀(已知生成沉淀的Ksp=1×10-31 )
②p点时产生沉淀与放出气体的物质的量之比为
③从开始加Na2O2固体至q点的整个过程中,总反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com