
【题目】氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应
2NH3是工业上合成氨的重要反应
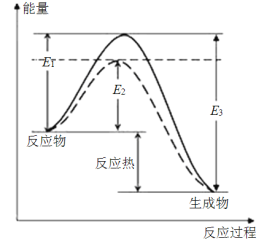
图1(图中表示生成1 mol物质时的能量)
根据图1请写出合成氨的热化学方程式:__________________(热量用E1、E2或E3表示)。
(2)LiAlH4是一种重要的储氢载体,能与水反应达到LiAlO2和氢气,该反应消耗1 mol LiAlH4时转移的电子数目为__________。
(3)氮化锂是非常有前途的储氢材料,其在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_____%(精确到0.1)。
LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_____%(精确到0.1)。
(4)LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠,已知电池放电时总反应式为FePO4+Li![]() LiFePO4 ,电池正极反应为____________________。
LiFePO4 ,电池正极反应为____________________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
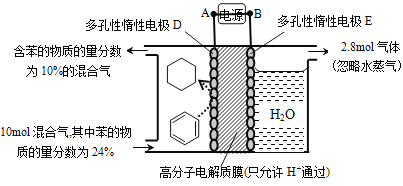
①导线中电子移动方向为____________。(用A、D表示)
②生成目标产物的电极反应式为__________________________。
③该储氢装置的电流效率![]() =__________________________。
=__________________________。
(![]() =
=![]() ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
【答案】(1)N2(g)+3H2g)![]() 2NH3(g) △H=2(E1E3)kJ·mol1
2NH3(g) △H=2(E1E3)kJ·mol1
(2)4NA或2.408×1024
(3)LiNH2 11.4
(4)FePO4+ Li ++e![]() LiFePO4
LiFePO4
(5)①A→D ②C6H6+6H++6e![]() C6H12 ③64.3%
C6H12 ③64.3%
【解析】本题主要是考查热化学方程式书写、氧化还原方程式的计算以及电化学原理的应用与计算。(1)反应物的总能量高于生成物总能量,反应是放热反应,反应的热化学方程式为N2(g)+3H2g)![]() 2NH3(g) △H=2(E1E3)kJ·mol1。
2NH3(g) △H=2(E1E3)kJ·mol1。
(2)LiAlH4是一种重要的储氢载体,能与水反应达到LiAlO2和氢气,反应前后Al元素的化合价不变,则反应前后Al元素的化合价均是+3价,因此反应前LiAlH4中氢元素的化合价是-1价,水中氢元素的化合价是+1价,LiAlH4中氢元素的化合价从-1价升高到0价,因此该反应消耗1 mol LiAlH4时转移的电子数目为4NA或2.408×1024。
(3)氢气中氢元素的化合价部分升高到+1价,部分降低到-1价,所以氧化产物为LiNH2;该反应中,反应掉2 mol氢气,同时消耗1 mol氮化锂,所以储存氢气最多可达Li3N质量的:4/35×100%≈11.4%。
(4)已知电池放电时总反应式为FePO4+Li![]() LiFePO4,因此电池正极反应为FePO4+ Li ++e
LiFePO4,因此电池正极反应为FePO4+ Li ++e![]() LiFePO4。(5)①苯生成环戊烷属于得氢反应,因此是还原反应,即电极D是阴极,电极E是阳极,因此导线中电子的流动方向是A→D。②苯得到电子生成环戊烷是目标产物,由于存在质子交换膜,所以氢离子向阴极移动,则电极反应式为C6H6+6H++6e-
LiFePO4。(5)①苯生成环戊烷属于得氢反应,因此是还原反应,即电极D是阴极,电极E是阳极,因此导线中电子的流动方向是A→D。②苯得到电子生成环戊烷是目标产物,由于存在质子交换膜,所以氢离子向阴极移动,则电极反应式为C6H6+6H++6e-![]() C6H12。③阳极生成2.8 mol气体,该气体应该是阳极OH-放电生成的氧气,则转移电子的物质的量=2.8 mol×4=11.2 mol。阴极除生成环己烷外,还生成H2:2H++2e-===H2↑,由题意可知,2n(H2)+6n(C6H12)=11.2 mol,[10 mol+n(H2)]×10%=10 mol×24%-n(C6H12);解得n(H2)=2 mol,n(C6H12)=1.2 mol,根据电极反应式C6H6+6H++6e-
C6H12。③阳极生成2.8 mol气体,该气体应该是阳极OH-放电生成的氧气,则转移电子的物质的量=2.8 mol×4=11.2 mol。阴极除生成环己烷外,还生成H2:2H++2e-===H2↑,由题意可知,2n(H2)+6n(C6H12)=11.2 mol,[10 mol+n(H2)]×10%=10 mol×24%-n(C6H12);解得n(H2)=2 mol,n(C6H12)=1.2 mol,根据电极反应式C6H6+6H++6e-![]() C6H12可知生成1.2 mol C6H12时得到电子是7.2 mol,因此储氢装置的电流效率=
C6H12可知生成1.2 mol C6H12时得到电子是7.2 mol,因此储氢装置的电流效率=![]() ×100%=64.3%。
×100%=64.3%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列试剂中,可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3四种溶液的是
A. NaOH B. H2SO4 C. NH3·H2O D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理_______。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
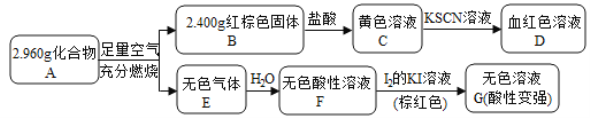
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L1),该气体分子的电子式为____。写出该反应的离子方程式__________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 在标准状况下,1mol任何物质的体积为22.4L
B. 含等物质的量的溶质的盐酸和硫酸中,H+的物质的量也相等
C. 1 mol H2和1mol He中,所含的分子数相同、原子数相同
D. 体积为6L的O2,其质量可能为8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是
A. 钡可从氯化钠溶液中置换出金属钠
B. 钡可从冷水中置换出氢气
C. 钡可从硫酸铜溶液中置换出铜
D. 在溶液中Ba2+可氧化金属锌,生成Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量。称取1.59 g样品,溶于水配成250.00 mL溶液,取出该溶液25.00 mL用0.1 mol·L-1盐酸进行滴定,得到如下曲线。以下说法或操作正确的是( )
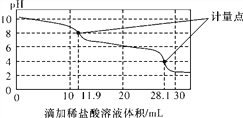
A. 上一个计量点前发生反应的离子方程式为HCO(+H+===H2O+CO2↑
B. 下一个计量点溶液中存在大量的阴离子是Cl-、HCO(
C. 此样品n(NaHCO3)=(28.1-2×11.9)×10-4 mol
D. 使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓氯水 | NaBr | 淀粉KI溶液 | 氧化性:Cl2>Br2>I2 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | Br2的苯溶液 | 铁屑 | AgNO3溶液 | 苯与溴单质在铁催化剂作用下 发生取代反应 | |
D | 硝酸 | Na2SO3 | KMnO4溶液 | SO2能使KMnO4溶液褪色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
G是抗炎症药物的中间体,其合成过程如下:
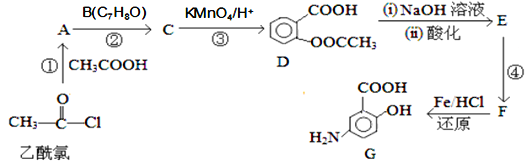
已知:Ⅰ. Ⅱ.
Ⅱ. (具有较强的还原性)
(具有较强的还原性)
(1)B的结构简式为_________;
(2)反应④的条件为_________;反应①的反应类型为_______;反应②的作用是_________ ;
(3)下列关于G中的描述正确的是___________;
A.具有两性,既能与酸反应也能与碱反应
B.能发生加成、消去、取代和氧化反应
C.能聚合成高分子化合物
D.1molG与足量NaHCO3溶液反应放出2molCO2
(4)D与足量的NaOH溶液反应的化学方程式为_______________________________
(5)符合下列条件的C的同分异构体有_________种
a.属于芳香族化合物,且含有两个甲基 b.能发生银镜反应
c.与FeCl3溶液发生显色反应
其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的是_____________________。
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻对位;苯环上有羧基时,新引入的取代基连在苯环的间位。依据题意,写出以甲苯为原料合成邻氨基苯甲酸的流程图(无机试剂任选):_____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com