
| A. | 0.4mol | B. | 0.2mol | C. | 2mol | D. | 4mol |
分析 Cu和浓硫酸反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,根据转移电子和被还原硫酸的关系式计算.
解答 解:Cu和浓硫酸反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,该反应中浓硫酸有一半作氧化剂、一半作酸,每1mol硫酸被还原时转移电子物质的量=1mol×(6-4)=2mol,所以如果电子转移0.4mol,则被还原的硫酸的物质的量=$\frac{0.4mol}{2}×1$=0.2mol,故选B.
点评 本题以浓硫酸为载体考查氧化还原反应的计算,侧重考查分析计算能力,明确浓硫酸的作用是解本题关键,知道作氧化剂的浓硫酸和转移电子的关系,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Rb2CO3易溶、易电离 | |
| B. | Rb位于周期表第五周期第ⅠA族 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷和盐酸反应的离子方程式是OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温、低压 | B. | 低温、高压 | C. | 低温、低压 | D. | 高温、高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化性浓H2SO4>Br2,还原性:SO2>HBr | |
| B. | 它们互为可逆反应 | |
| C. | 反应条件的改变引起了反应方向的改变,它们都符合事实 | |
| D. | 它们相互矛盾,不可能符合事实 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol水的摩尔质量是1mol 水的摩尔质量的2倍 | |
| B. | 阿伏伽德罗常数就是6.02×1023 | |
| C. | 6.02×1023 mol-1叫做阿伏伽德罗常数 | |
| D. | 科学上规定含6.02×1023个粒子的任何粒子集合体计量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶液 | 加入的物质 | 答案序号 |
| 饱和石灰水 | 通CO2至过量 | |
| AlCl3溶液 | 通过量的NH3 | |
| 含少量NaOH的NaAlO2溶液 | 通过量的CO2 | |
| NaAlO2溶液 | 滴加稀HCl至过量 | |
| MgCl2 AlCl3的混和液 | 滴加NaOH至过量 |
| A. |  | B. | 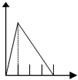 | C. | 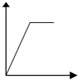 | D. |  | ||||
| E. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com