
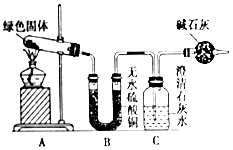
 ͭ�����ã����������һ����ɫ���壬ij��ѧ��ȤС���ռ�����ͭ���������ɫ�������̽��������������Ϻ�֪����ɫ�����Ǽ�ʽ̼��ͭ����С��ͬѧ������ͼװ�ý���ʵ�飬̽����ʽ̼��ͭ�ķֽ���
ͭ�����ã����������һ����ɫ���壬ij��ѧ��ȤС���ռ�����ͭ���������ɫ�������̽��������������Ϻ�֪����ɫ�����Ǽ�ʽ̼��ͭ����С��ͬѧ������ͼװ�ý���ʵ�飬̽����ʽ̼��ͭ�ķֽ������� �ٶ��Թ��ڵ���ɫ������м��ȣ�Bװ������ˮ����ͭ�����ɫ��˵���ֽ��������ˮ������Cװ���г���ʯ��ˮ����ǣ�˵���ֽ�������ж�����̼��
��ȡ�������Ⱥ����ɵĺ�ɫ�������Թ��У�����ϡ���ᣬ�۲쵽��ɫ�������ܽ⣬��Һ�����ɫ�����ɫ����ΪCuO��
��ȡ����������ɫ��Һ�����Թ��У�����һ���ྻ����˿���۲쵽��˿�����к�ɫ����������������Cu�����Ը���ɫ�����к���C��H��O��CuԪ�أ�
��1���ɷ�����֪��ɫ����ΪCuO��
��2����ɫ�����Ǽ�ʽ̼��ͭ�����ȷֽ���������ͭ��������̼��ˮ����
��3���������Fe��ͭ���ӷ�Ӧ����Cu���������ӣ�
��4��װ��C�Ǽ��������̼�ģ�Ҫ��������еĶ�����̼����C�����������ţ�
��� �⣺��1��ȡ�������Ⱥ����ɵĺ�ɫ�������Թ��У�����ϡ���ᣬ�۲쵽��ɫ�������ܽ⣬��Һ�����ɫ�����ɫ����ΪCuO��
�ʴ�Ϊ��CuO��
��2������ɫ�����Ǽ�ʽ̼��ͭ���仯ѧʽΪ��Cu2��OH��2CO3����ʽ̼��ͭ���ȷֽ���������ͭ��������̼��ˮ����Ӧ�ķ���ʽΪ��Cu2��OH��2CO3$\frac{\underline{\;\;��\;\;}}{\;}$2CuO+H2O��+CO2����
�ʴ�Ϊ��Cu2��OH��2CO3$\frac{\underline{\;\;��\;\;}}{\;}$2CuO+H2O��+CO2����
��3���������Fe��ͭ���ӷ�Ӧ����Cu���������ӣ��䷴Ӧ�����ӷ���ʽΪ��Fe+Cu2+=Cu+Fe2+��
�ʴ�Ϊ��Fe+Cu2+=Cu+Fe2+��
��4��װ��C�Ǽ��������̼�ģ�Ҫ��������еĶ�����̼����C�����������ţ�����ʵ��װ�����ĸ���ܵ������Ƿ�ֹ�����е�CO2������ƿ��
�ʴ�Ϊ����ֹ�����е�CO2������ƿ��
���� ���⿼����Cu���仯�������ʡ�̽�����ʵ���ɵ�ʵ�飬��Ŀ�Ѷ��еȣ������ڿ���ѧ����Ԫ�ػ��������ʵ�Ӧ��������ʵ��̽��������


 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д� ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������ˮ������ | B�� | ̼���ƿ��������첣��������� | ||
| C�� | ����������������켯�ɵ�· | D�� | Na2O2����DZˮͧ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 $\stackrel{����}{��}$
$\stackrel{����}{��}$ 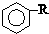 +HCl
+HCl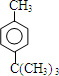 ��
�� ��
��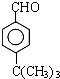 ��
��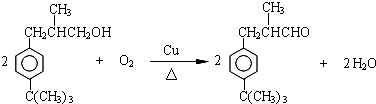 ��
��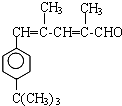 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���߾��ж����ЧӦ | B�� | ���߾�������Ĥ | ||
| C�� | ��ɢ�����ӿ�ͨ����ֽ | D�� | ���������ȳ���������ܽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ��Ŀ�� | ʵ����� | |
| A | �Ʊ�Fe��OH��3���� | �����͵�FeCl3��Һ�μӵ�NaOHŨ��Һ�� |
| B | ��MgCl2��Һ�Ʊ���ˮMgCl2 | ��MgCl2��Һ�������ɣ����ȹ��� |
| C | ��ȥHBr�л��е�Br2 | �������ͨ��ʢ��CCl4��ϴ��ƿ |
| D | ֤��Cu��OH��2���ܶȻ���Mg��OH��2��С | ��1mL0.1mol•L-1MgSO4��Һ��ε���4mL0.1mol•L-1NaOH��Һ���ٵμ�1mL0.1mol•LCuSO4��Һ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.4mol | B�� | ��0.2mol | ||
| C�� | ����0.2mol | D�� | ����0.2mol����0.4mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10s�ڣ�X��ƽ����Ӧ����Ϊ0.025 mol•L-1•s-1 | |
| B�� | ��10sʱ��Y�ķ�Ӧ����Ϊ0.075 mol•L-1•s-1 | |
| C�� | ��10sʱ��XΪ 1.5 mol��Y��Ũ��Ϊ0.25 mol•L-1 | |
| D�� | 10s�ڣ�X��Y��Ӧ�ų�������Ϊa kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K+��Na+��Cl-��SO32- | B�� | K+��Na+��NO3-��SO42- | ||
| C�� | K+��NH4+��NO3-��SO42- | D�� | K+��Mg2+��NO3-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ư�ۻ�Ư�۾����ڱ�¶�ڿ����л���ʣ�Ca��ClO��2+CO2+H2O�TCaCO3��+2HClO 2HClO=2 HCl+O2�� | |
| B�� | FeCl3��Һ�м������ۣ�����뼸��KSCN��Һ��δ����Һ��죺2Fe3++Fe�T3 Fe2+ | |
| C�� | ��ˮ����ʢ�й������ƹ�����Թ��У��ų����壬��ʹ�����ǵ�ľ����ȼ��2Na2O2+2 H2O�T4 NaOH+O2�� | |
| D�� | �������ʵ���֮��Ϊ1��2��������Һ�� Ba��OH��2��Һ��ϣ����ɰ�ɫ������Al3++2SO42-+2Ba2++4 OH-�T2 BaSO4��+Al��OH��3��+H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com