
下列有关电池叙述不正确的是( )
| A.锌锰干电池是一种常用的二次电池 |
| B.氢氧燃料电池比火力发电的能量转变率要高 |
| C.锌锰干电池工作一段时间后锌外壳逐渐变薄 |
| D.碱性燃料电池正极反应是O2 + 2H2O + 4e- =4OH- |
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:单选题
碘盐的主要成分是KIO3和NaCl,KIO3在工业上可用电解法制取,以石墨和铁为电极,电解KI溶液,反应方程式为KI+3H2O=KIO3 +3H2↑。下列有关说法中正确的是
| A.电解时,石墨作阴极,铁作阳极 |
| B.电解时,在阴极上产生KIO3 |
| C.电解后电解质溶液pH变大 |
| D.电解中每转移0.6mol e-,理论上可得到0.1mol无水KIO3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将铁片和银片用导线连接置于同一稀盐酸中,经过一段时间后,下列叙述正确的是
| A.负极有Cl2逸出,正极有H2逸出 | B.负极附近Cl-的浓度逐渐减小 |
| C.正极附近Cl-的浓度逐渐增大 | D.溶液中Cl-的浓度基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将锌片和铜片用导线连接后平行放入稀硫酸中,发生原电池反应,下列叙述错误的是
| A.溶液的pH增大 |
| B.溶液中的Zn2+浓度增大 |
| C.溶液中的SO42— 浓度增大 |
| D.溶液的密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)氢氧化钾是重要的工业产品。请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是 。
(2)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请简述原因: 。
③除去杂质后的氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(共10分)如图装置中,已知A、B两池溶液的体积均为200mL: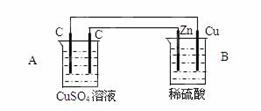
(1)判断装置的名称:A池为 ;
(2)A池中左边石墨棒为 极,
电极反应式为 ;
A池中总反应化学方程式为 ;
(3)若反应开始时,CuSO4溶液的浓度为1.0mol/L。工作一段时间后取出电极,测得导线上通过了0.04mole-。则反应后A池c(Cu2+)为 mol/L(体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的_______极,发生的电极反应为_______________。
(2)该电池工作时(放电)反应的总化学方程式为___________________________________。
Ⅱ.铅蓄电池是化学电源,它工作时的电池反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O;
试回答:
(3)铅蓄电池正极的电极材料是_____________。
(4)工作时该铅蓄电池负极的电极反应是_____________________。
(5)铅蓄电池工作时,电解质溶液的密度_______(填“减小”“增大”或“不变”,下同),pH_______。
(6)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,当制得0.05molCl2时,在理论上电池内部消耗的H2SO4的物质的量是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(27分)(1)现有如下两个反应:①NaOH + HCl =" NaCl" + H2O;②Fe +H2SO4 = FeSO4 + H2 ↑
两反应中为放热反应的是 ,能设计成原电池的是 。(填序号)
(2)根据下图填空①电子从 片流出,溶液中H+向 片移动。
② 正极的现象是 ,发生 反应(填写“氧化”或“还原”)。
③负极的电极方程式为
④ 若反应过程中有0.01mol电子发生转移,则生成的氢气在标准状况下的体积为 L。
(3)写出电解氯化铜溶液时,阴极的电极反应方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com