
【题目】硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。

已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;长期放置或者100°C以上发生分解,生成二氧化硫和氯气。回答下列问题:
(1)仪器C的名称是_______________,冷凝管的进水方向______(填“a”或“b”)。
(2)下列操作或描述正确的是_________________。
A.将70%硫酸换成98.3%硫酸,可以加快制取SO2的速率
B.实验中通过观察乙、丁导管口产生气泡的速率相等,可控制两种反应物体积相等
C.装置戊上方分液漏斗中最好选用0.10 molL-1NaCl溶液,减小氯气的溶解度
D.装置己防止污染,又防止硫酰氯变质
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,写出反应方程式:____________________。
(4)硫酰氯在潮湿空气中“发烟”,原因是_______________________(用化学方程式表示)。
(5)若反应中消耗的二氧化硫体积为560 mL(标准状况下),最后经过分离提纯得到2.7 g纯净的硫酰氯,则硫酰氯的产率为_______。
【答案】蒸馏烧瓶 a BD 2ClSO3H![]() SO2Cl2 + H2SO4 SO2Cl2+2H2O=H2SO4+2HCl 80%
SO2Cl2 + H2SO4 SO2Cl2+2H2O=H2SO4+2HCl 80%
【解析】
甲中产生二氧化硫,乙中除去二氧化硫中的杂质同时便于观察气流的速率;丙为两种气体混合反应的反应器;丁为除去氯气中的杂质同时便于观察气流速率;戊中贮存氯气,已为尾气吸收,防止空气中的水蒸气进入。据此回答。
(1) 仪器C的名称为蒸馏烧瓶。冷凝管的冷却水方向为从下进上出,所以进水方向为a。 (2) A.将70%硫酸换成98.3%硫酸,反应接触不充分,所以不能加快制取SO2的速率,故错误;B.实验中通过观察乙、丁导管口产生气泡的速率相等,可以使两种气体的体积相等,控制两种反应物体积相等,故正确;C.装置戊上方分液漏斗中最好选用饱和NaCl溶液,减小氯气的溶解度,故错误;D.装置最后用碱石灰吸收二氧化硫或氯气等有害气体,又能防止水蒸气进入,所以该装置己防止污染,又防止硫酰氯变质,故正确。故选BD。(3) 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,根据质量守恒分析,方程式为:2ClSO3H![]() SO2Cl2 + H2SO4 。(4) 硫酰氯在潮湿空气中“发烟”,说明其与水发生反应,根据质量守恒或元素化合价分析,产物应为硫酸和盐酸,方程式为:SO2Cl2+2H2O=H2SO4+2HCl。(5) 二氧化硫体积为560 mL,其物质的量为0.56/22.4=0.025mol,2.7克硫酰氯的物质的量为2.7/135=0.02mol,则产率为0.02/0.025= 80%。
SO2Cl2 + H2SO4 。(4) 硫酰氯在潮湿空气中“发烟”,说明其与水发生反应,根据质量守恒或元素化合价分析,产物应为硫酸和盐酸,方程式为:SO2Cl2+2H2O=H2SO4+2HCl。(5) 二氧化硫体积为560 mL,其物质的量为0.56/22.4=0.025mol,2.7克硫酰氯的物质的量为2.7/135=0.02mol,则产率为0.02/0.025= 80%。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A.1mol任何纯净物都含有相同的原子数
B.1mol O2中约含有6.02×1023个氧气分子
C.1mol氢中含有2mol氢原子
D.阿伏加德罗常数就是6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关。下列做法值得提倡的是
A.小苏打用作净水剂B.“地沟油”加工为生物燃料
C.饮高度酒预防新冠肺炎D.漂粉精作食品漂白剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.同主族元素氢化物的稳定性,自上而下逐渐增强
B.电子结构相同的微粒,它们的化学性质亦相同
C.元素Si、P、S、C1最高价含氧酸的酸性依次增强
D.同周期的短周期元素自左而右原子半径依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是![]() 和
和![]() ,电解质溶液为
,电解质溶液为![]() 溶液,电极反应为:
溶液,电极反应为:![]() ,
,![]() 。根据上述反应式,完成下列题目。
。根据上述反应式,完成下列题目。

①下列叙述正确的是_______。
![]() .在使用过程中,K+流向Zn极
.在使用过程中,K+流向Zn极
![]() .使用过程中,电子由
.使用过程中,电子由![]() 极经外电路流向
极经外电路流向![]() 极
极
![]() .
.![]() 是负极,
是负极,![]() 是正极
是正极
![]() .
.![]() 电极发生还原反应,
电极发生还原反应,![]() 电极发生氧化反应
电极发生氧化反应
②写出电池的总反应式:________________________________________________________________ 。
③使用时,电解质溶液的![]() ________。
________。
(2)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-2PbSO4+2H2O,请回答下列问题:①放电时,正极的电极反应式是 _____________________________________________________________________;
②电解液中![]() 的浓度将变_______;
的浓度将变_______;
③当外电路通过![]() 电子时,理论上负极板的质量增加_______
电子时,理论上负极板的质量增加_______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物CH3-CO-O-CH2-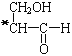 具有光学活性,若将该物质与某物质在一定条件下发生反应,使所得的生成物没有化学活性。根据你设计的反应写出无光学活性生成物的结构简式:__________________、__________________、__________________、__________________。
具有光学活性,若将该物质与某物质在一定条件下发生反应,使所得的生成物没有化学活性。根据你设计的反应写出无光学活性生成物的结构简式:__________________、__________________、__________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:
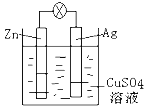
①Zn电极是_______(填“正极”或“负极”),反应中质量会变______(填“大”,“小”或“不变”)
②银电极上发生_____反应(“氧化”或“还原”),电极反应式为__________。
(2)甲醇(CH3OH)是一种重要的化工原料,在生产中有着重要的应用。甲醇燃料电池能量转化率高,对环境无污染。该燃料电池的工作原理如图所示:(质子交换膜可以通过H+)
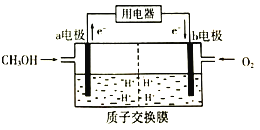
通入甲醇气体的电极为电池的_____(填“正”或“负")极,电解质溶液中H+向_____电极移动(填“a"或“b")。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的结构与二氧化碳相似,电子式为______________,硫原子的结构示意图______________
(2)羰基硫的氢解和水解反应是两种常用的脱硫方法:
氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7kJ/mol
H2S(g)+CO(g) ΔH1=+7kJ/mol
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-34kJ/mol
H2S(g)+CO2(g) ΔH2=-34kJ/mol
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
表示CO燃烧热的热化学方程式为________。
(3)氢解反应平衡后保持温度和压强不变通入适量的He,则正反应速率___________,COS的转化率_______(填“增大”、“减小”或“不变”)。
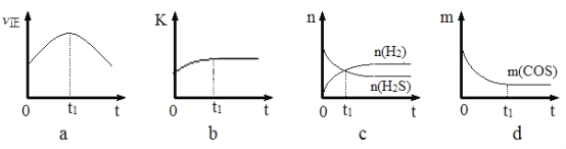
(4)若在绝热、恒容的密闭体系中,投入一定量COS(g)和H2(g),发生氢解反应,下列示意图能说明t1时刻反应达到平衡状态的是______(填字母序号)。(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(5)某温度下,在体积为2 L密闭的容器中通入2molCOS(g)和4molH2O(g)发生上述水解反应,5 min后达到平衡,测得COS(g)的转化率是75%,回答下列问题:
①v(H2S)=________mol/(L·min)
②该温度下平衡常数K=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2L的密闭容器中充入A气体、B气体,其浓度分别为2 mol/L,1 mol/L,且发生如下反应:3A(g)+2B(g) 4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5:4,则下列说法中正确的是( )
①该反应的化学平衡常数表达式为:![]()
②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变
④增加C的量,A、B转化率不变
A. ①②B. ②③C. ③④D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com