
| A. | 25℃时,100mLPH=1的CH3COOH溶液中含有的H+总数大于0.01NA | |
| B. | 标准状况下,11g3H216O种含有的质子数为6NA | |
| C. | 1molLi2O和Na2O2的混合物中含有的离子总数为3NA | |
| D. | 1molN2与足量H2混合,充分反映后转移电子数为6NA |
分析 A、pH=1的醋酸溶液中,氢离子的浓度为0.1mol/L;
B、3H216O的摩尔质量为22g/mol;
C、Li2O和Na2O2均由2个阳离子和1个阴离子构成;
D、氮气和氢气的反应为可逆反应.
解答 解:A、pH=1的醋酸溶液中,氢离子的浓度为0.1mol/L,故100mL溶液中的氢离子的物质的量n=CV=0.1mol/L×0.1L=0.01mol,个数为0.01NA个,故A错误;
B、3H216O的摩尔质量为22g/mol,故11g3H216O的物质的量n=$\frac{11g}{22g/mol}$=0.5mol,故含5NA个质子,故B错误;
C、Li2O和Na2O2均由2个阳离子和1个阴离子构成,故1mol混合物中含3NA个离子,故C正确;
D、氮气和氢气的反应为可逆反应,故不能反应完全,则转移的电子数小于6NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Z为0.3 mol•L-1 | B. | Y2为0.1 mol•L-1 | C. | X2为0.2 mol•L-1 | D. | Z为0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
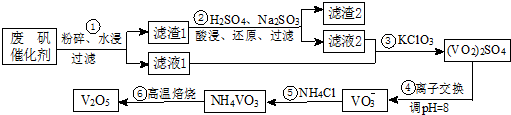
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
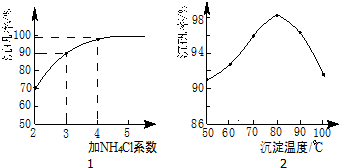
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4甲基4,5二乙基己烷 | B. | 2,3-二甲基-2,4-戊二烯 | ||
| C. | CH3CH(OH)CH2CH3:丁醇 | D. | 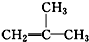 :2-甲基-1-丙烯 :2-甲基-1-丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
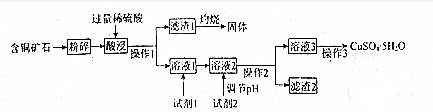
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.0 | 6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)=H2O(l)△H=-44kJ/mol,所以该过程是放热反应 | |
| B. | 人类利用的能源都是通过化学反应获得的 | |
| C. | 2CO(g)+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2(g)△H<0,则56gCO和32gO2所具有的总能里大于88g所具有的总能量 | |
| D. | 需要加热的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
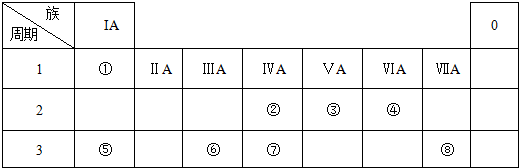
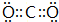 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com