
| A. | NaOH溶液不能用带磨口玻璃塞的玻璃瓶盛放 | |
| B. | CO2与水反应生成碳酸,是酸性氧化物;SiO2不能与水反应生成硅酸,不是酸性氧化物 | |
| C. | 除去二氧化硅中少量的碳酸钙杂质应选用水 | |
| D. | 粗硅制备时,发生的反应为C+SiO2═Si+CO2↑ |
分析 A、玻璃中含有二氧化硅,与碱反应生成硅酸盐是矿物胶;
B、酸性氧化物与碱反应生成盐与水,二氧化硅与氢氧化钠反应生成硅酸钠与水;
C、二氧化硅不与盐酸反应,而碳酸钙能够与盐酸反应;
D、粗硅制备时,发生的反应为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
解答 解:A、玻璃中的二氧化硅和氢氧化钠溶液反应生成的硅酸钠溶液具有黏性,能把玻璃塞黏住,所以不能盛放在带有玻璃塞的试剂瓶中,故A正确;
B、酸性氧化物与碱反应生成盐与水,二氧化硅与氢氧化钠反应生成硅酸钠与水,所以二氧化硅是酸性氧化物,故B错误;
C、除去二氧化硅中的少量碳酸钙:二氧化硅不与盐酸反应,而碳酸钙能够盐酸反应而溶解,可以将固体溶液盐酸中,然后过滤、洗涤、干燥得到纯净的二氧化硅,所以选盐酸,故C错误;
D、粗硅制备时,发生的反应为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,生成一氧化碳而不是二氧化碳,故D错误;
故选A.
点评 本题考查了化学试剂的存在,难度不大,注意玻璃的成分中含有二氧化硅,二氧化硅能和强碱或氢氟酸反应,所以强碱溶液不能用带玻璃塞的试剂瓶存放,碱式滴定管下端不是玻璃塞是橡胶管.


科目:高中化学 来源: 题型:解答题
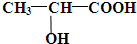
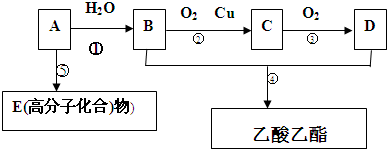
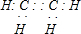
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的系统命名法为2,5-二甲基-4-乙基己烷 的系统命名法为2,5-二甲基-4-乙基己烷 | |
| B. | 全降解塑料(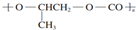 )可由单体环氧丙烷( )可由单体环氧丙烷(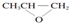 )和CO2加聚制得 )和CO2加聚制得 | |
| C. | 1mol乙酰水杨酸(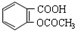 )最多可以和2molNaOH反应 )最多可以和2molNaOH反应 | |
| D. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )的混和物溶于100mL 1mol/L NaOH溶液中,然后用0.5mol/L H2SO4溶液滴定过量的NaOH,消耗硫酸溶液30mL.另取m g上述混和物溶于过量甲醇中,加入少量浓硫酸,加热使完全反应,分离、精制,得到酯的混和物,其质量比 m g增加15.8%,则m的数值为多少?
)的混和物溶于100mL 1mol/L NaOH溶液中,然后用0.5mol/L H2SO4溶液滴定过量的NaOH,消耗硫酸溶液30mL.另取m g上述混和物溶于过量甲醇中,加入少量浓硫酸,加热使完全反应,分离、精制,得到酯的混和物,其质量比 m g增加15.8%,则m的数值为多少?查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(H+)>c(OH-)>c(Cl-)>c(NH4+) | D. | c(H+)>c(Cl-)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Q1+Q2<Q3,则反应为放热反应 | B. | 若Q1+Q2<2Q3,则反应为放热反应 | ||
| C. | 若E1+E2>E3,则反应为放热反应 | D. | 若E1+E2>E3,则反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com