
| A£® | ÓĆ“æ¼īČÜŅŗČܽā±½·Ó£ŗCO32-+C6H5OH”śC6H5O-+HCO3- | |
| B£® | ÓĆĒæ¼īČÜŅŗĪüŹÕ¹¤ŅµÖĘČ”ĻõĖįĪ²ĘųNO+NO2+2OH-=2NO3-+H2O | |
| C£® | ÓƶžŃõ»ÆĆĢŗĶÅØŃĪĖį·“Ó¦ÖĘĀČĘų£ŗMnO2+4HCl£ØÅØ£© $\frac{\underline{\;\;”÷\;\;}}{\;}$Mn2++2Cl-+Cl2”ü+2H2O | |
| D£® | ĻņAlCl3ČÜŅŗÖŠµĪ¼Ó¹żĮæµÄ°±Ė®£ŗAl3++4NH3•H2O=AlO2-+2H2O |
·ÖĪö A£®±½·ÓµÄĖįŠŌ“óÓŚĢ¼ĖįĒāøłĄė×Ó£¬Ģ¼ĖįÄĘÓė±½·Ó·“Ӧɜ³É±½·ÓÄĘŗĶĢ¼ĖįĒāÄĘ£»
B£®Ąė×Ó·½³ĢŹ½Į½±ßŃõŌŖĖŲ²»ŹŲŗć£»
C£®Ąė×Ó·½³ĢŹ½ÖŠ£¬ÅØŃĪĖįÖŠµÄĀČ»ÆĒāÓ¦øĆ²šæŖ£»
D£®Ņ»Ė®ŗĻ°±ĪŖČõ¼ī£¬¶žÕß·“Ӧɜ³ÉĒāŃõ»ÆĀĮ³Įµķ£®
½ā“š ½ā£ŗA£®Ģ¼ĖįÄĘÓė±½·Ó·¢Éś·“Ó¦£ŗCO32-+C6H5OH”śC6H5O-+HCO3-£¬æÉÓĆ“æ¼īČÜŅŗČܽā±½·Ó£¬¹ŹAÕżČ·£»
B£®ÓĆĒæ¼īČÜŅŗĪüŹÕ¹¤ŅµÖĘČ”ĻõĖįĪ²Ęų£¬ÕżČ·µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗNO+NO2+2OH-=2NO2-+2H2O£¬¹ŹB“ķĪó£»
C£®ÓƶžŃõ»ÆĆĢŗĶÅØŃĪĖį·“Ó¦ÖĘĀČĘų£¬HClÓ¦øĆ²šæŖ£¬ÕżČ·µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗMnO2+4H++2Cl- $\frac{\underline{\;\;”÷\;\;}}{\;}$Mn2++Cl2”ü+2H2O£¬¹ŹC“ķĪó£»
D£®ĻņAlCl3ČÜŅŗÖŠµĪ¼Ó¹żĮæµÄ°±Ė®£¬·“Ӧɜ³ÉĒāŃõ»ÆĀĮ³ĮµķŗĶĀČ»Æļ§£¬ÕżČ·µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗAl3++3NH3•H2O=Al£ØOH£©3”ż+3NH4+£¬¹ŹD“ķĪó£»
¹ŹŃ”A£®
µćĘĄ ±¾Ģāæ¼²éĮĖĄė×Ó·½³ĢŹ½µÄŹéŠ“ÅŠ¶Ļ£¬ĪŖøßæ¼µÄøßʵĢā£¬ĢāÄæÄŃ¶Č²»“ó£¬×¢ŅāĆ÷Č·Ąė×Ó·½³ĢŹ½ÕżĪóÅŠ¶Ļ³£ÓĆ·½·Ø£ŗ¼ģ²é·“Ó¦Īļ”¢Éś³ÉĪļŹĒ·ńÕżČ·£¬¼ģ²éø÷ĪļÖŹ²š·ÖŹĒ·ńÕżČ·£¬ČēÄŃČÜĪļ”¢Čõµē½āÖŹµČŠčŅŖ±£Įō»ÆѧŹ½£¬¼ģ²éŹĒ·ń·ūŗĻŹŲŗć¹ŲĻµ£ØČē£ŗÖŹĮæŹŲŗćŗĶµēŗÉŹŲŗćµČ£©µČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
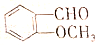 ÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壮ĘäÖŠŗ¬ÓŠ±½»·ĒŅÄÜ·¢ÉśĖ®½ā·“Ó¦µÄÓŠ£Ø””””£©
ÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壮ĘäÖŠŗ¬ÓŠ±½»·ĒŅÄÜ·¢ÉśĖ®½ā·“Ó¦µÄÓŠ£Ø””””£©| A£® | 3ÖÖ | B£® | 4ÖÖ | C£® | 5ÖÖ | D£® | 6ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
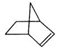 £¬½µ±łĘ¬Ļ©ŌŚŅ»¶ØµÄĢõ¼žĻĀæÉŅŌ×Ŗ»ÆĪŖ½µ±łĘ¬Ķé£ØČēĶ¼ĖłŹ¾£©£ŗ
£¬½µ±łĘ¬Ļ©ŌŚŅ»¶ØµÄĢõ¼žĻĀæÉŅŌ×Ŗ»ÆĪŖ½µ±łĘ¬Ķé£ØČēĶ¼ĖłŹ¾£©£ŗ £¬Ōņ½µ±łĘ¬ĶéµÄ¶žĀČČ”“śĪļ¹²ÓŠ10ÖÖ£®
£¬Ōņ½µ±łĘ¬ĶéµÄ¶žĀČČ”“śĪļ¹²ÓŠ10ÖÖ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | SO2ŗĶSO3»„ĪŖĶ¬·ÖŅģ¹¹Ģå | |
| B£® | ¶žŃõ»ÆĢ¼ŗĶøɱł»„ĪŖĶ¬ĖŲŅģŠĪĢå | |
| C£® | CH3CH2OHŗĶ CH3-O-CH3 »„ĪŖĶ¬·ÖŅģ¹¹Ģå | |
| D£® | ŗģĮ×ŗĶ°×Į×»„ĪŖĶ¬Ī»ĖŲ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÉżøßĪĀ¶Č£¬BµÄ°Ł·Öŗ¬ĮæŌö¼Ó | |
| B£® | µ±ČŻĘ÷ÖŠĘųĢåµÄĆÜ¶Č²»±äŹ±£¬·“Ó¦“ļµ½Ę½ŗā | |
| C£® | ¼ÓČėÉŁĮæK£¬Äę·“Ó¦ĖŁĀŹŌö“ó | |
| D£® | Ę½ŗāŗó¼ÓČėA£¬ÉĻŹö·“Ó¦µÄ”÷HŌö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ü¢Ż | B£® | ¢Ł¢Ż¢Ž | C£® | ¢Ś¢Ū¢Ü | D£® | ¢Ü¢Ż¢Ž |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com