
| A、大力开发和利用生物质能,促进可再生能源的发展 |
| B、利用核能、水库、潮汐等发电,可以减少火力发电对煤等化石燃料的使用 |
| C、H2是理想的绿色能源,可用电解水的方法进行获得 |
| D、推广利用太阳能、风能的照明系统,有利于实现城市的“蓝天工程” |


科目:高中化学 来源: 题型:

| 压强/Mpa/体积分数/%/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 82.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl=H2SO4>CH3COOH |
| B、HCl>H2SO4>CH3COOH |
| C、H2SO4>HCl>CH3COOH |
| D、HCl=H2SO4=CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述四种元素的原子半径大小为X>Y>Z>W |
| B、化合物X2W2中存在两种类型的化学键 |
| C、依据最高价氧化物对应水化物的碱性强弱可以比较X和Y的金属性强弱 |
| D、W、Z的氢化物的沸点:HmW<HmZ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,46g的NO2和N2O4混合气体含有的分子数为NA | ||
| B、1mol Fe粉与1mol水蒸气充分反应转移的电子数为2NA | ||
C、标准状况下,1L乙醇完全燃烧产生CO2分子的数目为
| ||
| D、1molCH3+中含有电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| A、溶液中水电离出的c(H+)=10-10mol/L |
| B、溶液中c(H+)+c(A-)=0.1mol/L |
| C、溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大 |
| D、与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为 c(A-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-183 kJ/mol |
| B、-91.5 kJ/mol |
| C、+183 kJ/mol |
| D、+91.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
- 3 |
2- 3 |
- 3 |
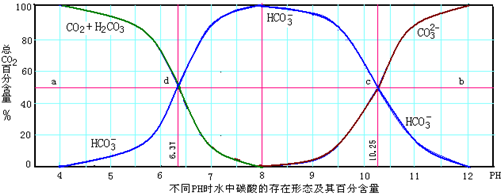
- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com