
【题目】软锰矿(主要成分为MnO2)可用于制备锰及其化合物,现代冶炼金属锰的工艺流程如下图所示,步骤中杂质离子逐一沉淀。

下表为t℃时,有关物质的Ksp
物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
Ksp | 4.0×10-38 | 2.2 | 5.5 | 1.9 | 6.3 | 9.1 | 2.5 | 2.2 |
软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4===12MnSO4+6CO2↑+18H2O
(1)写出一种能提高还原浸出速率的措施:_________________________
(2)调节pH 步骤中生成的沉淀为________。加入MnF2的主要目的是除去__________ (填“Ca2+”、“Fe3+”或“Cu2+”)
(3)等浓度的(NH4)2S与(N4)2SO4 溶液中,NH4+的浓度大小为:前者________后者(填“>”、“< ” “=” )。
(4)由MnSO4制取MnCO3往MnSO4溶液中加入(NH4)2CO3溶液生成MnCO3,同时还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)![]() Mn(OH)2(s)+CO
Mn(OH)2(s)+CO![]() (aq),t℃时,计算该反应的平衡常数K=_________________(保留一位小数)。
(aq),t℃时,计算该反应的平衡常数K=_________________(保留一位小数)。
【答案】 提高反应温度或将软锰矿研细等其他合理答案 Fe(OH)3 Ca2+ < 115.8 或1.2ⅹ102
【解析】软锰矿还原浸出得到硫酸锰溶液,说明浸取液为稀硫酸,同时溶液中还含有Ca2+、Fe3+、Cu2+等杂质,调节溶液的pH,Fe(OH)3的Ksp为4.0×10-38与其它离子相比最小,调节pH可以将Fe(OH)3沉淀下来,向滤液中加入硫化铵,CuS的Ksp为6.3×10-36,可以将铜离子形成硫化物沉淀下来,再加入MnF2,形成CaF2沉淀,除去Ca2+,最后对得到的含有锰离子的盐电解,可以得到金属锰,以此解答。
(1)反应物接触面积越大、温度越高反应速率越快,所以能提高还原浸出速率的措施:升高反应温度或将软锰矿研细等;
因此,本题正确答案是:提高反应温度或将软锰矿研细等其他合理答案;
(2)调节溶液的pH,Fe(OH)3的Ksp为4.0×10-38与其它离子相比最小,调节pH可以将 Fe(OH)3沉淀下来;CaF2难溶于水,滤液2中含有Mn2+、Ca2+、NH4+、SO42-,加入MnF2的目的是形成CaF2沉淀,除去Ca2+;
因此,本题正确答案是:Fe(OH)3 ;Ca2+;
(3)S2-水解显碱性,促进NH4+水解,所以等浓度的(NH4)2S与(NH4)2SO4 溶液中,NH4+的浓度大小为:前者<后者,
因此,本题正确答案是:<;
(4)由MnCO3(s)+2OH-(aq) ![]() Mn(OH)2(s)+CO
Mn(OH)2(s)+CO![]() (aq),可知,
(aq),可知,
K=![]() =
=![]() =
=![]() =115.8;
=115.8;
因此,本题正确答案是:115.8 或1.2![]() 102。
102。


科目:高中化学 来源: 题型:
【题目】《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点。已知铊有两种天然同位素![]() 和
和![]() 。下列关于
。下列关于![]() 说法正确的是( )
说法正确的是( )
A. 中子数与质子数之差为122B. 中子数与电子数之差为122
C. 质量数与中子数之差为81D. 质量数与电子数之差为81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的两种氧化物在化工生产中都有着重要的用途。
I.CuO可用于制备Cu2O。
已知:①2Cu2O(s)![]() 4Cu(s)+O2(g) △H1=+338kJ·mol-1;
4Cu(s)+O2(g) △H1=+338kJ·mol-1;
②2CuO(s)![]() 2Cu(s)+O2(g) △H2=+314kJ·mol-1。
2Cu(s)+O2(g) △H2=+314kJ·mol-1。
(1)CuO分解生成2molCu2O的热化学方程式为____________________________________。
(2)温度为T时,向5L恒容密闭容器中加人80g CuO制备Cu2O,5min时恰好达到平衡,测得容器中Cu2O的物质的量为0.4mol。
①该反应的平衡常数K=_____________________。
②5min时缩小容器容积,重新达到平衡时O2的浓度_________(填“增大”“减小”或“不变”)。
③其他条件不变,起始向该容器中充入0.5molCuO,重复实验,达到平衡的时间_____2.5min(填“大于”“小于”或“等于”);达到平衡时Cu2O的物质的量______0.2mol(填“大于”“小于”或“等于”)。
(3)研究表明,在CuO中加入适量碳粉,下列说法中有利于制得纳米级Cu2O的是_____(填选项字母)。
A.碳与氧气反应放热,加快反应速率
B.生成CO气体,使固体颗粒容易分散
C.CO可以将Cu2O还原为铜粉
D.CO作该反应的催化剂
II.CuO可用于冶炼铜(已知:CO的燃烧热△H=-283kJ/mol),一定条件下,将1molCuO和0.5molCO加人2L密闭容器中发生反应,t1时达到平衡,t2后改变容器中的条件,用CO表示的反应速率(v)与时间(t)的关系如图所示(三个阶段改变的条件为温度、压强、浓度中的一个)。
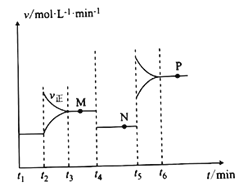
(4)t4时改变的条件为______________________________________________。
(5)M、N、P三点对应状态下,CO的转化率a(M)、a(N)、a(P)的大小关系为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如右图所示,下列有关叙述正确的是( )
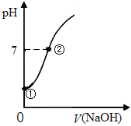
A. ①点所示溶液中只存在HClO的电离平衡
B. ①到②水的电离程度逐渐减小
C. I-能在②点所示溶液中存在
D. ②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___________________________________________。
(2)实验室用50mL0.50mol·L-1盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为___________________________;实验室提供了0.50mol·L-1和0.55mol·L-1两种浓度的NaOH溶液,应选择___________mol·L-1的NaOH溶液进行实验。

(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

①在阳极区发生的反应包括__________________________________和H++HCO===H2O+CO2↑。
②简述CO![]() 在阴极区再生的原理:____________________________________。
在阴极区再生的原理:____________________________________。
(4)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,试计算溶液中![]() =_______。(常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)
=_______。(常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | 50 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
(1)写出实验中发生反应的离子方程式:___________,该反应是_____反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花____ s。
(3)对比结果B与F,解释结果F那么快的原因:________
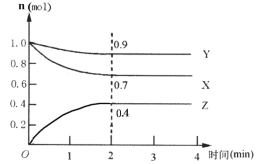
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体)。
(1)该反应的的化学方程式为_______;
(2)反应开始至2分钟时,X的平均反应速率为______;
(3)能说明该反应已达到平衡状态的是______;
a.每消耗3molX,同时消耗1molY
b.容器内压强保持不变
c.Z的浓度不再变化
d.容器内混合气体的密度保持不变
(4)由下图求得平衡时Y的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。2R-C≡C-H![]() R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为________,D的化学名称为________。
(2)①和③的反应类型分别为________、________。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气__ mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3∶1,写出其中3种的结构简式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊在元素周期表中的相对位置如图所示。下列说法正确的是
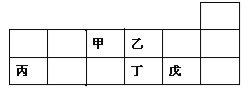
A. 原子半径的大小顺序为:甲>乙>丙>戊
B. 氢化物的稳定性:乙>丁;氢化物的沸点:丁>乙
C. 元素甲与元素丙的最高正化合价之和的数值等于8
D. 元素戊的氧化物对应的水化物的酸性一定比丁的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com