
| A. | SO2 | B. | NaHCO3 | C. | HCl | D. | NaOH |
分析 A.向溶液中通入二氧化硫,二氧化硫和氯气发生氧化还原反应,导致平衡向逆反应方向移动,则次氯酸浓度降低;
B.向溶液中加入NaHCO3,NaHCO3和稀盐酸反应导致平衡向正反应方向移动,次氯酸和NaHCO3不反应,所以次氯酸浓度增大;
C.加入HCl,HCl的浓度增大,使平衡向逆反应方向移动,则次氯酸浓度降低;
D.向溶液中加入NaOH,NaOH和HCl、HClO都反应,所以导致HClO浓度降低.
解答 解:A.SO2+2H2O+Cl2=H2SO4+2HCl,所以氯水中通入硫化氢后,氯气浓度减小,则HClO浓度降低,故A错误;
B.NaHCO3+HCl=NaCl+H2O+CO2↑,已知HClO是比H2CO3还弱的酸,HClO和碳酸氢钠不反应,所以加入碳酸氢钠后平衡向正反应方向移动,则HClO浓度增加,故B正确;
C.加入HCl,溶液中氢离子浓度增大,抑制氯气和水反应,则HClO浓度降低,故C错误;
D.NaOH+HCl=NaCl+H2O、HClO+NaOH=NaClO+H2O,促进氯气和水反应,但溶液中HClO浓度降低,故D错误;
故选B.
点评 本题考查了弱电解质的电离,题目难度不大,明确弱电解质电离特点、物质的性质即可解答,可以根据平衡移动原理进行判断,试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | SO3通入BaCl2溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | NH3通入MgCl2溶液中 | D. | Cl2通入KI淀粉溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取碳酸钠晶体53.0g | |
| B. | 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 | |
| C. | 定容时,俯视观察刻度线 | |
| D. | 定容后,将容量瓶反复倒转、摇匀、静置时发现液面低于刻度线,于是又加入少量水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
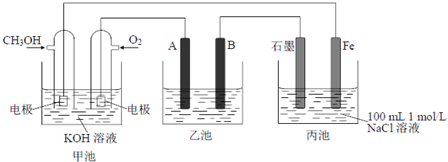
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质均为高分子化合物 | |
| B. | 利用溴的四氯化碳溶液可除去甲烷中的乙烯 | |
| C. | 煤中含有苯、甲苯等,可通过煤的干馏制取 | |
| D. | 苯滴入溴水中振荡后水层接近无色,因为发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,2-二氯乙烷在NaOH水溶液中加热发生消去反应得到乙炔 | |
| B. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| C. | 除去电石和水反应产生的乙炔中杂质气体,可用稀硫酸洗气 | |
| D. | 由丙烯酸甲酯CH2=CHCOOCH3合成的聚合物为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值增大 | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)>c(HCO3-),且2c(Na+)=3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | 常温下0.4 mol•L-1 HB溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-) | |
| D. | 假设HClO的电离平衡常数为Ka,碳酸的电离常数分别记为:Ka1和Ka2,已知:Ka1>Ka>Ka2,则发生反应:2NaClO+CO2(少量)+H2O═Na2CO3+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com