
| ||
| A.812kJ/mol | B.632kJ/mol |
| C.1264kJ/mol | D.1624kJ/mol |
科目:高中化学 来源:不详 题型:单选题
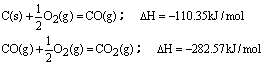
| A.39.292kJ | B.3274.3kJ | C.784.92kJ | D.2489.44kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 催化剂 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| ||
| A.该反应为吸热反应 | B.金刚石比石墨稳定 |
| C.该反应为氧化还原反应 | D.石墨比金刚石稳定 |
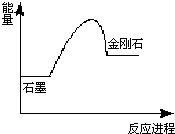
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| B.从C(石墨)═C(金刚石)△H=+1.19kJ?mol-1,可知:金刚石比石墨更稳定 |
| C.由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,可知:含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出热量大于57.3kJ |
| D.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
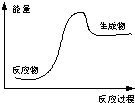
| A.酸与碱的中和反应 |
| B.NH4Cl和Ba(OH)2?8H2O的反应 |
| C.氧化钙和水反应 |
| D.甲烷的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.室温下不能自发进行的反应,在高温下有可能自发进行 |
| B.熵增加有利于反应的自发进行,熵减少的反应常温下都不会自发进行 |
| C.非自发反应在任何情况下都不会发生 |
| D.△H-T△S作为化学反应方向的判据,在任何条件下都适用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.方程式中的化学计量数表示分子数 |
| B.该反应△H大于零 |
| C.该反应△H=-571.6kJ/mo |
| D.该反应可表示36g水分解时的热效应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2H4+O2=N2+2H2O△H = —534.4kJ/mol |
| B.N2H4(g)+ O2(g)=N2(g)+2H2O(g)△H = —16.7kJ/mol |
| C.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H = —534.4kJ/mol |
| D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H = —534.4kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com