
【题目】室温下,向20 mL0.1 mol/L H2A溶液中逐滴加入0.1 mol/L NaOH溶液,H2A溶液中各粒子浓度分数δ(X)随溶液pH变化的关系如图所示。下列说法错误的是 ( )
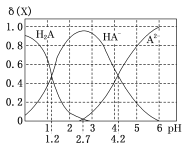
A.当溶液中A元素的主要存在形态为A2-时,溶液可能为弱酸性、中性或碱性
B.当加入NaOH溶液至20 mL时,溶液中存在((Na+)=2c(A2-)+c(HA-)
C.室温下,反应A2-+H2A=2HA-的平衡常数的对数值lgK=3
D.室温下,弱酸H2A的第一级电离平衡常数用Ka1表示,Na2A的第二级水解平衡常数用Kh2表示,则Kal>Kh2
【答案】B
【解析】
A、当溶液中A元素的主要存在形态为A2-时,溶液pH大于4.2,溶液可能为弱酸性、中性或碱性,故A正确;
B、HA与NaOH按1:1混合,所得溶液为NaHA溶液,由图可知,NaHA溶液呈酸性。根据电荷守恒得c(Na+)+c(H+)=2(A2-)+c(HA-)+c(OH-),因为c(H+)>c(OH-),所以c(Na+)<2c(A2-)+c(HA-),故B错误;
C、依据图像中两个交点可计算出Ka1=10-1.2,Ka2=10-4.2,室温下,反应A2-+H2A![]() 2HA-的平衡常数K=
2HA-的平衡常数K=![]() =103,lgK=3,故C正确;
=103,lgK=3,故C正确;
D、因为K1=10-1.2,所以Kh2=![]() ,故Ka1>kh2,故D正确;
,故Ka1>kh2,故D正确;
答案选B。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】CO和![]() 的某些性质及相关键能如下表所示,下列说法不正确的是
的某些性质及相关键能如下表所示,下列说法不正确的是
表一
分子 | 熔点 | 沸点 | 常温时在水中的溶解度 |
CO |
|
|
|
|
|
|
|
表二
碳氮键 |
|
|
|
键能 |
|
|
|
氮氮键 |
|
|
|
键键能 | 193 | 418 | 946 |
A.CO与![]() 的价电子总数相等
的价电子总数相等
B.由表2可知,CO的活泼性不及![]() ,因为
,因为![]() 的键能大于
的键能大于![]()
C.由表1可知,CO的熔沸点高于![]() ,因为CO分子间作用力大于
,因为CO分子间作用力大于![]()
D.由表1可知,室温时CO在水中的溶解度大于![]() ,因为CO是极性分子
,因为CO是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上用CO2和H2反应合成二甲醚,反应的热化学方程式为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ/mol。请回答:
CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ/mol。请回答:
①一定条件下,上述反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填序号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的n(CO2)/n(H2)值变小
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=________;KA、KB、KC三者的大小关系是_____________。
③上述合成二甲醚的过程中,提高CO2的转化率可采取的措施有_______________ (任写两种)。
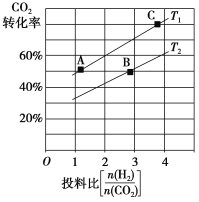
(2)用氨水吸收CO2可得到NH4HCO3溶液。若常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,在NH4HCO3溶液中,c(NH4+)________c(HCO3-)(填“>”、“<”或“=”),试计算常温下反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=___________;NH4HCO3溶液中物料守恒表达式为_________。
NH3·H2O+H2CO3的平衡常数K=___________;NH4HCO3溶液中物料守恒表达式为_________。
(3)绿色“二甲醚燃料电池”在酸性溶液中负极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物苯等在ZnCl2存在下,用甲醛和极浓盐酸处理,发生氯甲基化反应,在有机合成上甚为重要。下列有关该反应的说法正确的是 ( )
![]() +HCHO+HCl
+HCHO+HCl![]()
![]() +H2O
+H2O
A.有机产物A的分子式为C7H6Cl
B.有机产物A分子中所有原子均共平面
C.反应物苯是煤干馏的产物之一,是易挥发、易燃烧、有毒的液体
D.有机产物A的同分异构体(不包括自身)共有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮及其化合物的转化很有意义。下面是氮的氧化物在几种不同情况下的转化:
①已知:2SO2(g)+O2(g)![]() 2SO3(g) H= -196.6 kJmol-1
2SO3(g) H= -196.6 kJmol-1
2NO(g)+O2(g)![]() 2NO2(g) H=-113.0kJmol-1
2NO2(g) H=-113.0kJmol-1
则SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为:______________。
②a.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使其反应达到平衡,正反应速率随时间变化的示意图如图1所示。反应在c点________(“达到”或“未到”)平衡状态。
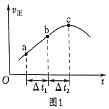
b.开始时,分别在该容器中加入Ⅰ:2mol SO2(g)和2 mol NO2(g)
Ⅱ:2 mol SO3(g)和2 mol NO(g)。则反应达到平衡时,比较容器Ⅰ和容器Ⅱ中反应平衡常数:Ⅰ____Ⅱ(填“>”“=”或“<”)。 .
(2)已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 molL-1,c始(H2O)=1 molL-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是________。此时刻v正________v逆(填“>”或“<”)。 .
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 molL-1,c始(H2O)=1 molL-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是________。此时刻v正________v逆(填“>”或“<”)。 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自20世纪80年代以来建立起的沼气发酵池,其生产的沼气用作燃料,残渣(沼渣)中除含有丰富的氮、磷、钾等常量元素外,还含有对作物生长起重要作用的硼、铜、铁、锌、锰、铬等微量元素,是一种非常好的有机肥。请回答下列问题:
(1)现代化学中,常利用___________上的特征谱线来鉴定元素。
(2)下列微粒基态的电子排布中未成对电子数由多到少的顺序是__________(填字母)。
a.Mn2+ B.Fe2+ C.Cu D.Cr
(3)P4易溶于CS2,难溶于水的原因是___________。
(4)铜离子易与氨水反应形成[Cu(NH3)4]2+配离子。
①[Cu(NH3)4]2+中提供孤电子对的成键原子是__________。
②研究发现NF3与NH3的空间构型相同,而NF3却难以与Cu2+形成配离子,其原因是___________。
(5)某晶胞中各原子的相对位置可用如图所示的坐标系表示:
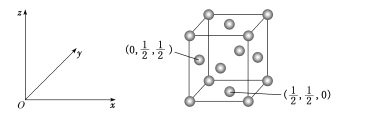
在铁(Fe)的一种立方晶系的晶体结构中,已知2个Fe原子坐标是(0,0,0)及(![]() ,
,![]() ,
,![]() ),且根据均摊法知每个晶胞中有2个Fe原子。
),且根据均摊法知每个晶胞中有2个Fe原子。
①根据以上信息,推断该晶体中原子的堆积方式是__________,
②已知晶体的密度为ρg·cm-3,Fe的摩尔质量是M g·mol-1,阿伏加德罗常数为NA,晶体中距离最近的两个铁原子之间的距离为_________ pm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向NaAlO2溶液中滴入NaHCO3溶液:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
B.MnO2与浓盐酸混合加热:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.FeSO4溶液中加入盐酸酸化的H2O2:Fe2++H2O2+2H+=Fe3++2H2O
D.Ca(HCO3)2溶液中加入过量氨水:Ca2++HCO3-+NH3·H2O=CaCO3↓+H2O+NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收利用废旧锂离子电池正极材料锰酸锂(LiMn2O4)的一种流程如下:
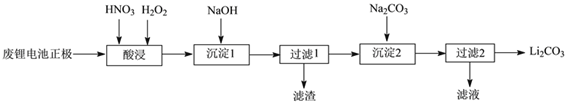
(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是_________。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为Mn(NO3)2、LiNO3等产物。请写出该反应离子方程式_________。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是_________。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_________。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是________。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25°C时,![]() ,
,![]() 。下列说法正确的是
。下列说法正确的是
A.25°C时,饱和![]() 溶液与饱和
溶液与饱和![]() 溶液相比,前者的
溶液相比,前者的![]() 大
大
B.25°C时,在![]() 的悬浊液加入少量的
的悬浊液加入少量的![]() 固体,
固体,![]() 增大
增大
C.25°C时,![]() 固体在20ml0.01 mol·
固体在20ml0.01 mol·![]() 氨水中的
氨水中的![]() 比在20mL0.01mol·
比在20mL0.01mol·![]()
![]() 溶液中的
溶液中的![]() 小
小
D.25°C时,在![]() 的悬浊液加入
的悬浊液加入![]() 溶液后,
溶液后,![]() 不可能转化成为
不可能转化成为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com