

| ||
| 高温高压 |
| ||
| 高温高压 |
| 5 |
| 56 |
| n |
| V |
| ||
| 2L |


科目:高中化学 来源: 题型:
| A、金属元素的原子只有还原性,离子只有氧化性 |
| B、金属单质在常温下均是固体 |
| C、金属元素能存在于阳离子中,而不能存在于阴离子中 |
| D、金属元素在化合物中一定显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、85.5% |
| B、66.7% |
| C、33.3% |
| D、27.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用分液漏斗分离乙醇和水 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用加热的方法分离氯化钠和硝酸钾固体 |
| D、用四氯化碳萃取碘的饱和水溶液中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.下列有关仪器的使用,能实现的是
Ⅰ.下列有关仪器的使用,能实现的是查看答案和解析>>
科目:高中化学 来源: 题型:
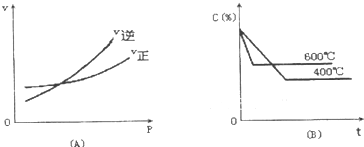 如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、4NH2(g)+5O2(g)?4NO(g)+6H2O(g)△H=-808.7Kj/mol |
| B、N2O3(g)?NO2(g)+NO(g)△H=+41.8Kj/mol |
| C、3NO2(g)+H2O(l)?2HNO2(l)+NO(g)△H=-261.3Kj/mol |
| D、CO2(g)+C(s)?2CO(g)△H=+171.4Kj/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com