
| ||
| ||


科目:高中化学 来源: 题型:
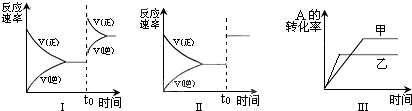
| A、图I研究的是t0时刻增大A的浓度对反应速率的影响 |
| B、图II研究的是t0时刻加入催化剂或增大压强后对反应速率的影响 |
| C、图III研究的是催化剂对平衡的影响,且乙的催化效率比甲高 |
| D、图III研究的是温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如图).请回答:C20分子共有
德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如图).请回答:C20分子共有查看答案和解析>>
科目:高中化学 来源: 题型:
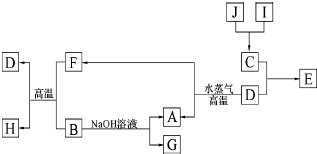
 A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出).
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出).查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=
(1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰和干冰均为分子晶体,冰的沸点、密度都高于干冰 |
| B、氢氧化钡晶体与氯化铵晶体反应的△H>0,所以该反应不可能自发进行 |
| C、常温下含有NA个NO2、N2O4分子的混合气体,降温至标准状况,其体积小于22.4 L |
| D、在蒸馏水中加入等体积的浓H2SO4,c(H+) 会增大,水的电离程度减小,但KW不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com