
| A、电子的质量不同 |
| B、电子的能量不同 |
| C、电子的数量不同 |
| D、电子的大小不同 |
科目:高中化学 来源: 题型:

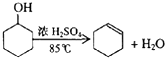
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 熔点(℃) | |
| 环乙醇 | 0.96 | 25 | 161 | 难溶于水 |
| 环乙烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
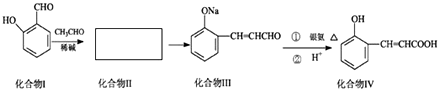
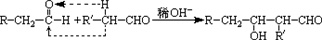
查看答案和解析>>
科目:高中化学 来源: 题型:
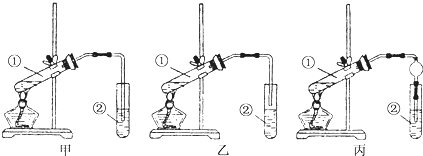
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 电解质溶液 | HBr | AgNO3 | BaCl2 | KOH |
| pH变化 | 变小 | 变大 | 不变 | 变大 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
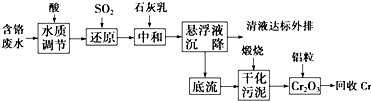 含铬废水、铬渣对环境的污染问题备受关注,通过化学原理对废物进行有效处理变废为宝是目前的一个重要研究课题.
含铬废水、铬渣对环境的污染问题备受关注,通过化学原理对废物进行有效处理变废为宝是目前的一个重要研究课题.查看答案和解析>>
科目:高中化学 来源: 题型:
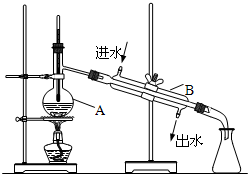 如图为实验室制取自来水的装置示意图,根据图示回答下列问题.
如图为实验室制取自来水的装置示意图,根据图示回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com