
分析 (1)摩尔质量单位为g/mol时,在数值上摩尔质量与相对分子质量相等;
(2)根据n=$\frac{m}{M}$计算该气体的物质的量;
(3)根据V=nVm计算标况下该气体的体积;
(4)根据ρ=$\frac{M}{{V}_{m}}$计算标况下该气体的密度;
(5)根据N=nNA结合该气体为双原子分子计算含有原子数;
(6)根据$\frac{M}{{N}_{A}}$可计算出该气体1个分子的质量.
解答 解:(1)该气体分子的相对分子质量为M,则该气体的摩尔质量为Mg/mol,
故答案为:M;
(2)mg该气体的物质的量为:n=$\frac{mg}{Mg/mol}$=$\frac{m}{M}$mol,
故答案为:$\frac{m}{M}$;
(3)mg该气体的物质的量为$\frac{m}{M}$mol,标况下该气体的体积为:22.4L/mol×$\frac{m}{M}$mol=$\frac{22.4m}{M}$L,
故答案为:$\frac{22.4m}{M}$;
(4)该气体在标准状况下的密度ρ=$\frac{M}{{V}_{m}}$=$\frac{Mg/mol}{22.4L/mol}$=$\frac{M}{22.4}$g/L,
故答案为:$\frac{M}{22.4}$;
(5)mg该气体的物质的量为$\frac{m}{M}$mol,该气体为双原子分子,则含有原子的物质的量为:$\frac{m}{M}$mol×2=$\frac{2m}{M}$mol,含有原子的数目为:N=$\frac{2m}{M}$mol×NAmol-1=$\frac{2m{N}_{A}}{M}$,
故答案为:$\frac{2m{N}_{A}}{M}$;
(6)该气体的一个分子的质量为:$\frac{Mg/mol}{{N}_{A}mo{l}^{-1}}$=$\frac{M}{{N}_{A}}$,
故答案为:$\frac{M}{{N}_{A}}$.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与其它物理量之间的关系即可解答,试题计算量较大,充分考查了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Z位于周期表第三周期第ⅦA族 | |
| B. | 简单离子半径由大到小排序:Z、T、X、Y | |
| C. | X、Y、Z的最高价氧化物对应的水化物能相互反应 | |
| D. | R2T2和X2T2中所含化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③⑤ | C. | ①②④⑤ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
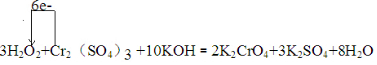 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3g | B. | 2.93g | C. | 1.15g | D. | 4.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$\stackrel{浓硝酸}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | |
| C. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | |
| D. | Cu$→_{△}^{浓硫酸}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com