
| A、1mol H2O所含有的原子数为NA |
| B、常温常压下,32g O2含有的氧原子数为2NA |
| C、常温常压下,11.2L Cl2所含的分子数为0.5NA |
| D、1L 0.1mol/L Na2SO4溶液中所含的Na+为0.1NA |


科目:高中化学 来源: 题型:
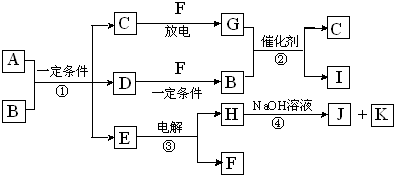
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验要求 | 试剂及方法 |
| 鉴别CuSO4、Na2SO4两种粉末 | |
| 检验自来水中是否含有Cl- | |
| 证明Na2CO3溶液具有碱性 | |
| 除去铁粉中混有少量铝粉 |
| A.用试纸测定溶液的pH |
| B.取样,加少量蒸馏水 |
| C.取样,加稀硝酸和硝酸银溶液 |
| D.加过量NaOH溶液后,过滤、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、CaCO3与CH3COOH溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、Na与H2O反应:2Na+2H2O=2Na++2OH-+H2↑ |
| D、FeCl3溶液与氨水反应:Fe3++3OH-=Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| A、使用催化剂是为了加快反应速率,提高生产效率 |
| B、上述条件下,SO2不可能100%转化为SO3; |
| C、达到平衡状态时,SO2浓度与SO3浓度相等 |
| D、达到平衡状态时,SO2的消耗速率与SO2的生成速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀盐酸滴入硝酸银溶液中:Ag++Cl-=AgCl↓ |
| B、稀硝酸滴在碳酸钙上:CO32-+2H+=CO2↑+H2O |
| C、稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
| D、氯气通入氯化亚铁溶液中:Fe2++Cl2=Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| O2 |
| △ |
| 焙烧 |
| 足量稀盐酸 |
| 操作Ⅰ |
| 蒸发结晶过滤 |
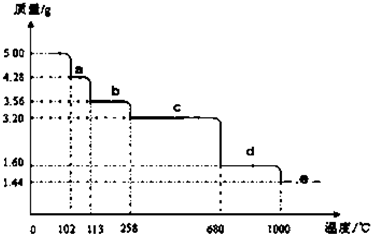
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com