
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Na+、CH3COO-、Br- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 0.1 mol?L-1 FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 由水电离的c (H+)=1×10-14 mol?L-1的溶液中:Ca2+、K+、Cl-、HCO${\;}_{3}^{-}$ |
分析 A.能使广泛pH试纸显蓝色的溶液显碱性,四种离子在碱性溶液中可共存;
B.该溶液中存在大量氢离子,偏铝酸根离子与氢离子反应;
C.铁离子与硫氰根离子反应;
D.该溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子与氢离子和氢氧根离子反应.
解答 解:A.能使广泛pH试纸显蓝色的溶液显碱性,K+、Na+、CH3COO-、Br-之间不反应,都不与氢氧根离子反应,在碱性溶液中可共存,故A正确;
B.甲基橙呈红色溶液显酸性,H+与AlO2-不共存,故B错误;
C.Fe3+与SCN-之间发生反应生成络合物,在溶液中不能大量共存,故C错误;
D.水电离的c(H+)=1×10-14mol?L-1的溶液可能为酸性也可能为碱性,HCO3-与酸与碱都不能共存,故D错误;
故选A.
点评 本题考查离子共存,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的无色溶液:MnO4- Na+ I- Mg2+ | |
| B. | 含有0.1mol/L Fe3+ 的溶液中:Na+ Ca2+ SCN- SO42- | |
| C. | 与铝片反应产生氢气的溶液:CO32- SO42- Na+ NH4+ | |
| D. | 使酚酞溶液变红的溶液:Na+ Cl- NO3- Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
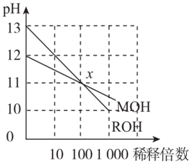
| A. | ROH是一种强碱,MOH是一种弱碱 | |
| B. | 等浓度的MOH与盐酸反应,所得溶液呈中性,则V(MOH)>V(盐酸) | |
| C. | 在x点,c(M+)=c(R+) | |
| D. | 稀释前,c(ROH)=10c(MOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属表面的氧化膜都很致密,能对金属起到保护作用 | |
| B. | 金属表面的氧化膜的形成都需要金属暴露在空气中很长时间才会形成 | |
| C. | 金属表面的氧化膜薄层的厚度会随着金属暴露在空气中的时间增长而加厚 | |
| D. | 某些金属表面氧化膜的形成对这些金属的广泛应用起到关键作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
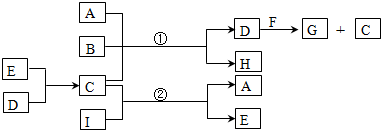
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 热稳定性:HF>HCl>HBr>HI | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸钠溶液与稀盐酸互滴时,两种操作现象不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
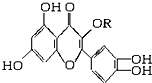 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1 mol该物质可与5 mol NaOH发生反应 | |
| B. | 1 mol该物质与足量浓溴水反应,最多消耗6 mol Br2 | |
| C. | 一定条件下1 mol该物质可与H2加成,消耗H2最大量为6 mol | |
| D. | 维生素P能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com