
| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l);△H=-Q1 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-Q2 kJ•mol-1 | |
| C. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1 | |
| D. | $\frac{1}{3}$H3PO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{6}$Ba3(PO4)2(s)+H2O(l);△H=-Q4 kJ•mol-1 |
分析 根据中和热是强酸和强碱的稀溶液完全反应生成1mol水时放出的热量,依据概念对选项分析判断.
解答 解:A、CH3COOH是弱电解质电离过程是吸热过程,反应后放热小于57.3kJ•mol-1,故A错误;
B、浓H2SO4稀释时要放热,反应后放热大于57.3kJ•mol-1,故B错误;
C、符合中和热的概念,是中和热的热化学方程式的表示方法,故C正确;
D、H3PO4是弱电解质,电离过程是吸热过程,反应后放热小于57.3kJ•mol-1,故D错误;
故选C.
点评 本题考查了中和热的概念理解和分析判断,关键是掌握中和热概念,弱电解质电离吸热,浓H2SO4稀释时要放热,生成沉淀放热,题目难度中等.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
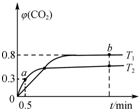 利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | T1<T2,△H>0 | |
| B. | T1温度下,该反应的平衡常数为1 024 | |
| C. | T2温度下,0~0.5 min内,CO的平均反应速率为0.3 mol•L-1•min-1 | |
| D. | T1温度下,若向装有足量I2固体的2 L恒容密闭容器中通入10 mol CO2,达到平衡时,φ(CO2)=0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 | |
| B. | 向淀粉溶液中加入稀H2SO4,水浴加热一段时间后,取出部分水解液滴加碘水,若溶液变蓝,证明淀粉未发生水解 | |
| C. | 将蔗糖和稀H2SO4加热水解后的液体取出少许,加入新制的Cu(OH)2并加热煮沸,无红色沉淀生成,证明蔗糖未发生水解生成葡萄糖 | |
| D. | 蛋白质溶液中加入丙酮可以使蛋白质从溶液中析出,再加水又能溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若金属有剩余,向溶液中再滴入硫酸后,金属可能溶解,也可能不溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 | |
| D. | 当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-$\frac{a}{3}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | C、D、E的半径:C>D>E | |
| D. | 化合物AE与CE有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | 原子最外层电子数是次外层的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 气态氢化物与最高氧化物对应水化物可发生化合反应 |
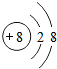 .写出元素Z的单质的电子式
.写出元素Z的单质的电子式 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com