
| A、+1 | B、+2 | C、+4 | D、+5 |


科目:高中化学 来源: 题型:
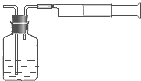 空气中SO2含量是重要的空气质量指标.在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg?Lˉ1
空气中SO2含量是重要的空气质量指标.在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg?Lˉ1查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CFClBrI分子中,各原子最外层均为8个电子 |
| B、含氧酸中,中心原子的化合价越高,其酸性越弱 |
| C、含有共价键的晶体一定具有高的熔、沸点及硬度 |
| D、金属晶体的空间利用率:简单立方堆积>六方最密堆积>体心立方堆积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、NH4+、SO42-、Cl- |
| B、OH-、Na+、H+、SO42- |
| C、Mg2+、Cl-、Na+、OH- |
| D、CO32-、H+、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
| B、可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
| C、石油分馏、煤的气化、海水晒盐、花生中提取花生油等过程都是物理变化 |
| D、黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V3>V2>V1 |
| B、V3=V2=V1 |
| C、V3>V2=V1 |
| D、V1=V2>V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| Y | CO2 | Fe2O3 | H2O | FeCl3 |
| W | MgO | Al2O3 | NaOH | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com