
| 溶液中被沉淀的离子 | Fe3+ | Cu2+ |
| 完全生成氢氧化物沉淀时溶液的pH | ≥3.7 | ≥4.4 |
科目:高中化学 来源: 题型:选择题
 “天宫一号”飞行器白天靠太阳能帆板产生电流向镍氢电池充电,夜间镍氢电池向飞行器供电.镍氢电池结构示意图如图.若电池总反应为:2Ni(OH)2 $?_{放电}^{充电}$ 2NiOOH+H2↑,则下列说法正确的是( )
“天宫一号”飞行器白天靠太阳能帆板产生电流向镍氢电池充电,夜间镍氢电池向飞行器供电.镍氢电池结构示意图如图.若电池总反应为:2Ni(OH)2 $?_{放电}^{充电}$ 2NiOOH+H2↑,则下列说法正确的是( )| A. | 充电时a极为阳极 | |
| B. | 放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| C. | 放电时NiOOH发生氧化反应 | |
| D. | 充电时,K+移向b极;放电时,OH-移向a极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LN2中一定含有6.02×1023个氮分子 | |
| B. | 1LH2O中溶解了0.5molNaCl,则该溶液的物质的量浓度为0.5mol/L | |
| C. | 从1L1mol/LC12H22O11溶液中取出10mL,则取出的10mL溶液物质的量的浓度仍为1mol/L | |
| D. | 1LH2SO4溶液中含有98g H2SO4,则该溶液的物质的量浓度为98g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 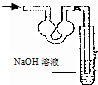 | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 |
| 完全沉淀的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| Z | W | |||
| M |
| A. | M与Y可能形成M2Y3和M2Y5化合物 | |
| B. | 原子半径大小关系:Z>X>Y | |
| C. | 不能通过电解熔融Z、W组成的物质制备Z单质 | |
| D. | Y可以形成多种氢化物,其沸点均比X与H形成的化合物高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物稳定性HmX>HnY | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质(X2)能将Y的阴离子(Y2-)氧化,并发生置换反应 | |
| D. | X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取8.10mL稀盐酸;用托盘天平称取25.0g氯化钠 | |
| B. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 | |
| C. | 用pH试纸测得某溶液的pH为2 | |
| D. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com