
| A. | 1mol O的质量是16g•mol-1 | B. | 1mol CO2的质量是44 g•mol-1 | ||
| C. | 氢的摩尔质量是2 g•mol-1 | D. | Na+的摩尔质量是23 g•mol-1 |
分析 A.质量的单位为g,g/mol为摩尔质量的单位;
B.g/mol为摩尔质量的单位;
C.没有指明是氢气还是氢原子;
D.钠离子和钠原子的摩尔质量相同,都是23g/mol.
解答 解:A.1mol O的质量是:16g/mol×1mol=16g,故A错误;
B.1mol CO2的质量是44 g•mol-1×1mol=44g,故B错误;
C.没有指明“氢”是氢原子还是氢气,故C错误;
D.电子的质量较小,则钠原子与钠离子的摩尔质量相同,都是23 g•mol-1,故D正确;
故选D.
点评 本题考查了物质的量的简单计算,题目难度不大,明确质量与摩尔质量之间的关系为解答关键,C为易错点,注意使用物质的量时必须指明粒子具体的存在形式,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 酒精受热变为气体 | B. | 氯化铵受热变为气体 | ||
| C. | 二氧化硅受热熔化 | D. | 食盐溶解在水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
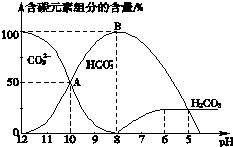 (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).| 次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(Fe3+)=0.1mol/L的溶液中:NH4+、I-、SO42-、Cl- | |
| B. | 加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3- | |
| C. | 0.1 mol•L-1AgNO3溶液:H+、K+、SO42-、Br- | |
| D. | pH=12的溶液中:K+、Cl-、CH3COO-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO32-+H2O?HCO3-+OH-:用热的纯碱溶液清洗油污 | |
| B. | A13++3H2O?AI(OH)3(胶体)+3H+:明矾净水 | |
| C. | SnCl2+H2O?Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液 | |
| D. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+3H+:制备TiO2纳米粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
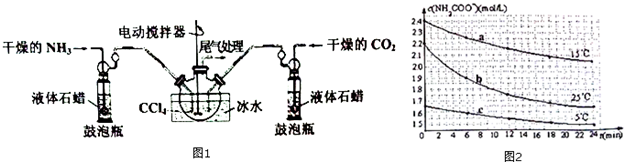
| 温度(℃) | 20.0 | 30.0 | 40.0 |
| 平衡时气体总浓度 (×10-3mol•L-1) | 3.4 | 4.8 | 6.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com