
【题目】资料显示,可用次氯酸钠处理废水中的氨氮(NH3),使其转化为氮气除去,其主要反应如下: ①NH3(aq)+HClO(aq)═NH2Cl(aq)+H2O(l)
②2NH2Cl(aq)+HClO(aq)═N2(g)+H2O(l)+3HCl(aq)
(1)在其他条件不变的情况下,向一定量废水中逐滴滴加次氯酸钠溶液,氨氮去除率随 ![]() 的变化曲线如图1:
的变化曲线如图1: 
Ⅰ.物质NH2Cl中氮元素的化合价是 .
Ⅱ.a﹣b点间,溶液中氨氮去除率迅速提高的原因是 .
(2)Ⅰ.反应①②中HClO 的来源用化学用语解释是 . Ⅱ.实验测得,废水中pH与氨氮去除率如图2所示:
pH较高时,氨氮去除率下降的原因是 .
pH较低时,氨氮去除率也下降,可能的原因是 .
(3)运用上述原理去除废水中的氨氮,可结合图3所示的电解法. Ⅰ.a极为 .
Ⅱ.d极反应式为 .
【答案】
(1)-1;c(NaClO)增大,水解平衡正向移动,使c(HClO)增大,NH3被氧化为N2速度加快
(2)ClO﹣+H2O?HClO+OH﹣;c(OH﹣)较大,抑制NaClO水解,c(HClO)较小致氧化能力弱;c(H+)较大,促进NaClO水解,c(HClO)太高致HClO易分解
(3)负极;Cl﹣﹣2e﹣+H2O=H++HClO
【解析】解:(1)Ⅰ.H为+1价,Cl为﹣1价,化合物中正负化合价的倒数和为0,则N元素的化合价为0﹣(+1)×2﹣(﹣1)=﹣1,所以答案是:﹣1;Ⅱ.a﹣b点间,溶液中氨氮去除率迅速提高的原因是c(NaClO)增大,水解平衡正向移动,使c(HClO)增大,NH3被氧化为N2速度加快,所以答案是:c(NaClO)增大,水解平衡正向移动,使c(HClO)增大,NH3被氧化为N2速度加快;(2)Ⅰ.反应①②中HClO 的来源用化学用语解释是ClO﹣+H2OHClO+OH﹣ , 所以答案是:ClO﹣+H2OHClO+OH﹣;Ⅱ.pH较大时,c(OH﹣)较大,抑制NaClO水解,c(HClO)较小致氧化能力弱,去除率降低;pH较小时,c(H+)较大,促进NaClO水解,c(HClO)太高致HClO易分解,去除率降低,所以答案是:c(OH﹣)较大,抑制NaClO水解,c(HClO)较小致氧化能力弱;c(H+)较大,促进NaClO水解,c(HClO)太高致HClO易分解;(3)由图可知,电解时Cl﹣失去电子转化为HClO,HClO可氧化氨气生成氮气,则d连接电源正极为阳极,可知a为负极,d为阳极,阳极反应为Cl﹣﹣2e﹣+H2O=H++HClO,所以答案是:负极;Cl﹣﹣2e﹣+H2O=H++HClO.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】一氧化氮是无色气体,难溶于水、密度比空气略大,在空气中能与氧气迅速反应生成红棕色的二氧化氮。在实验室中,收集一氧化氮时可选用的收集方法是( )
A. 排水集气法 B. 向上排空气集气法
C. 向下排空气集气法 D. 排水集气法或向上排空气集气法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的相对分子质量为56.
(1)该烃的分子式为 .
(2)若能使酸性KMnO4溶液褪色,则可能的结构简式有 .
(3)上述(2)中的混合物与足量H2反应后,所得产物共有种.
(4)上述(2)中的混合物若与足量HBr反应后,所得产物共有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3、NaHCO3、NaCl的固体混合物共4.0g,把它们加强热到质量不再减轻,冷却后称重为3.38g.在残余固体中加入过量的盐酸,产生CO20.88g.回答
(1)原混合物中NaHCO3的质量是多少克?
(2)原混合物中含NaCl克?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2 , 能将H2O2氧化。为了验证某小组学生设计了如下图所示的实验装置进行实验(夹持装置略去)。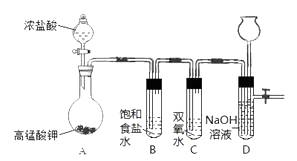
已知:2KMnO4+16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
试管B中饱和食盐水的主要作用是除去Cl2中混有的HCl
请回答下列问题。
(1)试管C发生反应的化学方程式是。
(2)试管D中NaOH溶液的作用是。
(3)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭D中止水夹,反应一段时间后试管D中的现象为 , 试管D中的气体检验方法为。
(4)有的同学对上述实验中D试管中的气体来源产生质疑,你认为可能的来源有(用方程式回答)。对于质疑可以采用对比实验来解决。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止富脂食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质,下列不属于抗氧化物质的是( )
A.生石灰B.还原铁粉C.亚硫酸钠D.维生素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲 | 乙 | 丙 | 戊 | |
① | NH3 | O2 | NO | H2O |
② | Fe | H2O | H2 | Fe2O3 |
③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
④ | Na2O2 | CO2 | O2 | Na |

A.①③
B.②③
C.②④
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由N2、H2合成NH3 . 制备H2需经多步完成,其中“水煤气(CO、H2)变换”是纯化H2的关键一步.
(1)水煤气变换:CO(g)+H2O(g)CO2(g)+H2(g),平衡常数K随温度变化如表:
温度/℃ | 200 | 300 | 400 |
K | 290 | 39 | 11.7 |
①下列分析正确的是 .
a.水煤气变换反应的△H<0
b.增大压强,可以提高CO的平衡转化率
c.增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
②以氨水为吸收剂脱除CO2 . 当其失去吸收能力时,通过加热使吸收剂再生.用化学方程式表示“吸收”、“再生”两个过程: .
(2)Fe3O4是水煤气变换反应的常用催化剂,经CO、H2还原Fe2O3制备.两次实验结果如表:
实验Ⅰ | 实验Ⅱ | |
通入气体 | CO、H2 | CO、H2、H2O(g) |
固体产物 | Fe3O4、Fe | Fe3O4 |
结合化学方程式解释H2O(g)的作用: .
(3)2016年我国某科研团队利用透氧膜,一步即获得N2、H2 , 工作原理如图所示.(空气中N2与O2的物质的量之比按4:1计) 
①起还原作用的物质是 .
②膜Ⅰ侧发生的电极反应式是 .
③膜Ⅰ侧所得气体 ![]() =3,CH4、H2O、O2反应的化学方程式是 .
=3,CH4、H2O、O2反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,所用仪器合理的是( )
A. 在坩埚中放入NaCl溶液,加热、蒸发得到NaCl晶体
B. 用10 mL的量筒量取9.20 mL的盐酸
C. 用托盘天平称取5.00 g NaCl
D. 用500 mL容量瓶配制450 mL 0.1 mol·L-1的盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com