
【题目】X、Y、Z、M、W为五种原子序数递增的前36号元素。X、Y是同周期元素,原子序数相差1,价电子数之和为11;Z为第三周期元素,价电子数为2;基态M原子有6个未成对电子;W属于ds区元素,有1个未成对电子。下列说法错误的是( )
A. 原子半径:Z>X>Y,电负性:Y>X>Z
B. X和Y的简单氢化物分子间均存在氢键,二者均可以作为配合物中的配体
C. Z(XY3)2晶体含离子键和共价键,酸根离子的中心原子杂化方式为sp2
D. M为ⅥB族元素,Z单质和W单质晶体的配位数均为12,空间利用率均为68%
【答案】D
【解析】
X、Y是同周期元素,原子序数相差1,价电子数之和为11;Z为第三周期元素,价电子数为2,则X为氮,Y为氧,Z为镁,基态M原子有6个未成对电子,核外电子排布式为1s22s22p63s23p63d54s1,为24号元素铬(Cr)。W属于ds区元素,有1个未成对电子,1s22s22p63s23p63d104s1 ,为29号元素铜(Cu)。
A. Z为第三周期,X、Y为第二周期,同周期元素从左至右原子半径依次减小,原子半径:Z>X>Y,非金属性越强,电负性越强,电负性:Y>X>Z,故A正确;
B. X和Y分别为氮和氧,简单氢化物分子间均存在氢键,二者核外均含有孤电子对,可以作为配合物中的配体,故B正确;
C. Z(XY3)2为Mg(NO3)2,是离子化合物,硝酸根内部以共价键相结合,晶体含离子键和共价键,硝酸根离子的中心原子为N,根据价电子对理论,中心原子的电子对数=3+![]() =3,硝酸根离子由4个原子组成,则杂化方式为sp2,故C正确;
=3,硝酸根离子由4个原子组成,则杂化方式为sp2,故C正确;
D. M为铬,属于ⅥB族元素,Z单质为镁,晶体结构为六方紧密堆积,配位数为12,空间利用率为74%;W单质为铜,晶体结构为面心立方堆积,配位数为12,空间利用率均为74%,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)烷烃A在同温、同压下蒸气的密度是H2的36倍,其分子式为___________。
(2)写出天然橡胶单体(2-甲基-1,3-丁二烯)的结构简式_________。
(3)立方烷![]() 的一氯代物有_________种,它的六氯代物有_________种。
的一氯代物有_________种,它的六氯代物有_________种。
(4)下列物质的沸点按由高到低的顺序排列正确的是___________。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③ (CH3)3CH ④ (CH3)2CHCH2CH3
A.②④①③ B. ④②①③ C.④③②① D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠和碳酸氢钠都是中学常见化学药品。
Ⅰ.下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的装置:
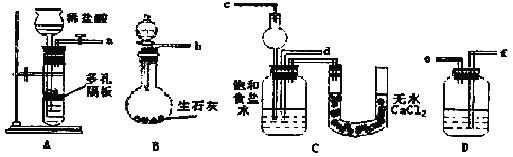
请回答下列问题(提示B分液漏斗中为浓氨水,滴入烧瓶可产生氨气):
(1)装置的连接顺序是:a接___,___接___;b接___。
(2)检查装置气密性后,必须先让___(填A或B)装置先发生反应。C中用球形干燥管而不用直导管,其作用是___。
(3)C中广口瓶内产生固体的总化学方程式为___。
Ⅱ.通过加热分解的方法可以测定碳酸钠和碳酸氢钠的含量。取13.08g碳酸钠和碳酸氢钠的混合物充分加热,将生成的CO2气体通入足量的澄清石灰水中,测得生成沉淀的质量为4.0g。
(4)加热时发生的化学反应方程式为___。
(5)原混合物中碳酸钠和碳酸氢钠的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁矿石(若只含铁的氧化物和SiO2)取36g溶于过量的稀盐酸中,过滤、洗涤、干燥后得5.6g不溶物,向得到的滤液中加入足量的NaOH溶液,过滤、洗涤后将沉淀灼烧,得32g红棕色固体.根据题意下列结论不正确的是( )
A. 由铁矿石转化为红棕色固体的过程中发生了氧化还原反应
B. 溶于盐酸后得到的滤液中n(Fe2+):n(Fe3+)=1:1
C. 铁矿石中的铁的氧化物的化学式一定是Fe3O4
D. 若稀盐酸为3.0molL﹣1 400mL,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是0.5molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 氧化还原反应一定属于四大基本反应类型
B. 氧化还原反应中,反应物不是氧化剂就是还原剂
C. 在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质
D. 失电子越多,还原性越强,得电子越多,氧化性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
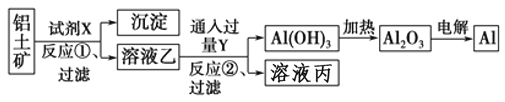
下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+![]() Cr3++Fe3++H2O ②,下列有关说法正确的是
Cr3++Fe3++H2O ②,下列有关说法正确的是
A. 还原性:Cr3+>SO2 B. 配平后方程式②中,a=6,b=7
C. Cr2O72-能将Na2SO3氧化成Na2SO4 D. 方程式①中W为OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体[NH4Al(SO4)2]的工艺流程如图所示:
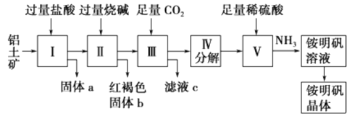
请回答下列问题:
(1)固体a的化学式为________,固体b化学式为________,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为__________________。
(3)由Ⅰ→Ⅱ→Ⅲ→Ⅳ都要用到的分离方法是__________________,由铵明矾溶液中制铵明矾晶体的操作是__________________。
(4)如果先向铝土矿加入过量氢氧化钠,再加入过量盐酸,此时首先出现的固体a是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知AgCl在水中的溶解是吸热过程。不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示。己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是
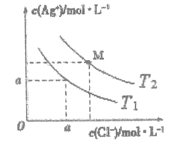
A. T1>T2
B. a =4.0×10-5
C. M点溶液温度变为T1时,溶液中Cl-的浓度不变
D. T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com