
【题目】下列关于金属的说法正确的是( )
A.铝箔在空气中受热可以熔化且会发生剧烈燃烧
B.Na在空气中燃烧,发出黄色火焰,生成白色固体
C.铁与水蒸气反应的产物是黑色的Fe2O3
D.铝制餐具不能用来盛装酸、碱、咸的食物
科目:高中化学 来源: 题型:
【题目】将7.28g Fe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+ , 待反应完全后,剩余Fe2+还需0.4mol/L KMnO4溶液25mL才能完全氧化,则KNO3的还原产物( )
A.NO
B.NO2
C.N2O
D.N2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的、酸性溶液中,能共存的离子组是( )
A.Na+ 、K+、SO42-、CO32-B.Na+、 K+、Cl、 NO3
C.Cu2+、K+、SO42-、NO3D.Ba2+、K+、Cl、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用Na2CO3和NaHCO3溶液进行如图所示实验。下列说法中,正确的是
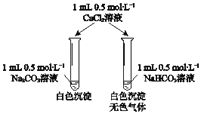
A. 实验前两溶液的pH相等 B. 实验前两溶液中离子种类完全相同
C. 加入CaCl2溶液后生成的沉淀一样多 D. 反应的离子方程式都是CO32-+Ca2+═CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。

(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用.例如:计算机芯片的主要成分是________;光导纤维的主要成分是________; 人们使用量最大的传统硅酸盐产品有水泥、玻璃和________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是( )
A. 可用托盘天平和小烧杯称取 10.2 g NaOH固体
B. 某实验需要 900 mL 0.1 mol/L的硫酸铜溶液,则配制该溶液需称取 22.5 g 胆矾晶体
C. 用 10 mL 量筒量取 5.2 mL 硫酸,仰视时实际量得的液体体积大于 5.2 mL
D. 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 同一生物体不同组织细胞内化学元素种类大体相同
B. C、H、O、N是组成生物体内抗体所必需的元素
C. 蛋白质中的S元素存在于氨基酸的R基中
D. 核酸中的N存在于碱基中,蛋白质中的N主要存在于羧基中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com