
Ⅰ.下列有关说法正确的是________。
A.相同类型的离子晶体,晶格能越大,形成的晶体越稳定
B.手性催化剂只催化或者主要催化一种手性分子的合成
C.用金属的电子气理论能合理地解释金属易腐蚀的原因
D.H3O+、NH4Cl和[Ag(NH3)2]+中均存在配位键
Ⅱ.碳及其化合物在自然界中广泛存在。
(1)基态碳原子的价电子排布图可表示为________。
(2)第一电离能:碳原子________(填“>”“<”或“=”)氧原子,原因是__________________________。
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似。每个冰晶胞平均占有________个水分子,冰晶胞与金刚石晶胞排列方式相同的原因是__________________________。
(4)C60的晶体中,分子为面心立方堆积,已知晶胞中C60分子间的最短距离为d cm,可计算C60晶体的密度为________g/cm3。
(5)请写出一个反应方程式以表达出反应前碳原子的杂化方式为sp2,反应后变为sp3:________________________________。
Ⅰ.ABD
Ⅱ.(1) 
(2)< 碳原子的半径比氧原子大,且核电荷数比氧的小,故碳原子核对最外层电子的吸引力小于氧
(3)8 每个水分子与相邻的4个水分子形成氢键
(4)
(5)CH2=CH2+Br2―→BrCH2CH2Br
【解析】Ⅰ.C项,用金属的电子气理论只能解释金属的物理性质,不能解释金属易腐蚀;D项,H3O+中H和O,NH4Cl中N和H、[Ag(NH3)2]+中Ag和N存在配位键。
Ⅱ.(3)金刚石的晶胞中8个C在顶点,6个碳在面心,4个C在内部,则每个冰晶胞平均占有水分子个数为8× +6×
+6× +4=8。(4)C60的晶体为面心立方堆积,则含C60的个数为8×
+4=8。(4)C60的晶体为面心立方堆积,则含C60的个数为8× +6×
+6× =4,设晶胞的边长为a,则
=4,设晶胞的边长为a,则 a=2d,a=
a=2d,a= d,故晶体的密度为
d,故晶体的密度为 。(5)sp2杂化的碳为形成双键碳原子,sp3杂化的碳为形成单键碳原子,可以是乙烯与Br2、H2、HX、H2O等的加成反应。
。(5)sp2杂化的碳为形成双键碳原子,sp3杂化的碳为形成单键碳原子,可以是乙烯与Br2、H2、HX、H2O等的加成反应。
点拨:本题考查物质结构和性质,考查考生对原子、分子、晶体结构和性质的理解能力。难度较大。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题14实验化学(选修)练习卷(解析版) 题型:选择题
下列实验操作、现象与实验结论一致的是( )。
选项实验操作、现象实验结论
A将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置氧化性:Fe3+>Br2>I2
B除锈的铁钉在浓硝酸中浸泡后,用蒸馏水洗净,再放入CuSO4溶液中无现象铁钉表面形成了一层致密稳定的氧化膜
C向某溶液中加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失该溶液中有SO42-
D甲苯中滴入少量浓溴水,振荡,静置,溴水层褪色萃取了浓溴水中的溴
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 电解质溶液练习卷(解析版) 题型:填空题
Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 __。
(2)检验溶液B中是否存在Fe3+的方法是 __。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | 氨水物质的量浓度/(mol·L-1) | 盐酸物质的量浓度/(mol·L-1) | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
请回答:
(4)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)= __mol·L-1;从第②组情况表明,c __(填“>”“<”或“=”)0.2 mol·L-1;从第③组情况分析可知,混合溶液中c(NH4+) __(填“>”“<”或“=”)c(NH3·H2O)。
(5)写出以下四组溶液NH4+浓度由大到小的顺序 __> __> __> __(填选项编号)。
A.0.1 mol·L-1 NH4Cl
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O
C.0.1 mol·L-1 NH3·H2O
D.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 HCl
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 电化学原理及其应用练习卷(解析版) 题型:选择题
某课外活动小组用如图所示装置进行实验(电解液足量)。下列说法中错误的是( )
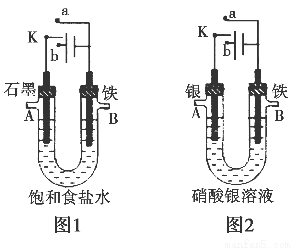
A.图1中,若开始实验时开关K与a连接,则B极的电极反应式为Fe-3e-=Fe3+
B.图1中,若开始实验时开关K与b连接,则一段时间后向电解液中通入适量HCl气体可恢复到电解前的浓度
C.图2中,若开始实验时开关K与a连接,则电解液的溶质质量分数变小
D.图2中,若开始实验时开关K与b连接,则A极减少的质量等于B极增加的质量
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 电化学原理及其应用练习卷(解析版) 题型:选择题
甲烷燃料电池,分别选择H2SO4溶液和NaOH溶液做电解质溶液,下列有关说法正确的是( )
A.总反应式都为CH4+2O2=CO2+2H2O
B.H2SO4和NaOH的物质的量都不变,但浓度都减小
C.若用H2SO4溶液做电解质溶液,负极反应式为CH4-4e-+H2O=CO2+4H+
D.若用NaOH溶液做电解质溶液,正极反应式为O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质结构与性质练习卷(解析版) 题型:选择题
下列有关物质结构和性质的说法中,正确的是( )
A.元素非金属性Cl>S的实验依据是酸性HCl>H2S。
B.碳元素的电负性小于氧元素,每个CO2分子中有4个σ键
C.同周期主族元素的原子形成的简单离子的电子层结构一定相同
D.Na、Mg、Al三种元素,其第一电离能由大到小的顺序为Mg>Al>Na
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质结构与性质练习卷(解析版) 题型:选择题
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4。下列说法正确的是( )
A.W、Y、Z的电负性大小顺序一定是Z>Y>W
B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C.Y、Z形成的分子的空间构型可能是正四面体
D.WY2分子中σ键与π键的数目之比是2:1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质的量及其应用练习卷(解析版) 题型:选择题
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 常见无机物及其应用练习卷(解析版) 题型:选择题
8.34 g FeSO4·7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。下列说法中正确的是( )

A.温度为78℃时固体物质M的化学式为FeSO4·5H2O
B.温度为159℃时固体物质N的化学式为FeSO4·3H2O
C.在隔绝空气条件下由N得到P的化学方程式为FeSO4 FeO+SO3↑
FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com