
分析 对于反应3Fe(s)+4H2O(g)?Fe3O4+4H2(g)来说,增大压强、浓度、升高温度以及增大固体的表面积,都可增大反应速率,以此解答.
解答 解:(1)因铁是固体,增加铁的量,没有增加铁的浓度,所以不能改变反应速率,故答案为:不变;
(2)容器的体积缩小,容器内各物质的浓度都增大,浓度越大,化学反应速率越快,故答案为:增大;
(3)体积不变,充入He使体系压强增大,但各物质的浓度不变,所以反应速率不变,故答案为:不变;
(4)压强不变,充入He使容器的体积增大,但各物质的浓度都减小,浓度越小,反应速率越小,故答案为:减小;
(5)将铁粉粉碎成更小的颗粒,固体表面积增大,反应速率增大,故答案为:增大.
点评 本题考查化学反应速率,为高频考点,侧重于学生的分析能力和基本理论、概念的综合理解和运用的考查,难度不大,注意相关基础知识的积累,易错点为(3)(4),注意压强与浓度的关系.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 明矾能够净水,是因为明矾水解生成的Al(OH)3胶体能杀死水中的细菌 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 提倡人们购物时不用塑料袋,是为了节约资源,减少白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
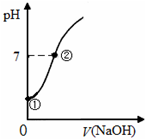 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HClO的电离平衡 | |
| B. | ①到②水的电离程度逐渐减小 | |
| C. | I-能在②点所示溶液中存在 | |
| D. | ②点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH>7的溶液一定是碱溶液 | |
| B. | pH试纸先用水润湿不一定会对测定结果造成偏差 | |
| C. | pH试纸应不经润湿直接放入待测液中 | |
| D. | 将酚酞溶液滴加到pH<7的溶液中会变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com