
| A. | 4.5 g | B. | 7.2 g | C. | 9.3 g | D. | 无法计算 |
分析 CO在氧气中完全燃烧生成CO2,CO2和再与Na2O2反应,方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2、2CO2+2Na2O2=2Na2CO3+O2,总方程式为:CO+Na2O2=Na2CO3,可知过氧化钠增重为CO的质量;
H2在氧气中完全燃烧,生成H2O,H2O再与Na2O2反应,方程式为2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O、2H2O+2Na2O2=4NaOH+O2,总反应方程式为:H2+Na2O2=2NaOH,可知反应后固体质量增加为氢气质量,以此解答该题.
解答 解:CO在氧气中完全燃烧生成CO2,CO2和再与Na2O2反应,方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2、2CO2+2Na2O2=2Na2CO3+O2,总方程式为:CO+Na2O2=Na2CO3,可知过氧化钠增重为CO的质量;
H2在氧气中完全燃烧,生成H2O,H2O再与Na2O2反应,方程式为2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O、2H2O+2Na2O2=4NaOH+O2,总反应方程式为:H2+Na2O2=2NaOH,可知反应后固体质量增加为氢气质量,
故由7.2gCO和H2组成的混合物在足量的O2中充分燃烧,立即通入足量的Na2O2固体,固体质量增加应为CO和H2的质量,即固体增重为7.2g,
故选B.
点评 本题考查混合物计算,侧重于学生的分析能力和计算能力的考查,注意利用总反应方程式判断固体增重,也可以利用差量法进行判断,难度中等.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:解答题
实验I: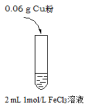 | 实验现象 |
| i.加入Cu粉后充分振荡,溶液变成浅蓝绿色; ii.取少量i中清液于试管中,滴加2滴1 mol/L KSCN溶液,立即出现白色沉淀,溶液变为红色,振荡后红色迅速褪去;继续滴加KSCN数滴溶液后,溶液又变为红色 |
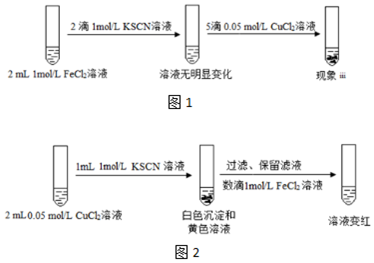
| 实验IV | 现象 |
| 向2mL 1mol/LFeCl3溶液中加入1滴1mol/L KSCN溶液,再加入足量的Cu粉 | 充分振荡,溶液红色褪去,有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有电子转移是氧化还原反应的本质,有元素化合价的变化是氧化还原反应的外在表现 | |
| B. | 一种物质被氧化,必然有另一种物质被还原 | |
| C. | 被氧化的物质得到或偏向电子,被还原的物质失去或偏离电子 | |
| D. | 氧化反应就是得到或偏向电子的反应,还原反应就是失去或偏离电子的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠失火时立即用水灭火,然后用稀硫酸中和 | |
| B. | 为了防止挥发,氢氧化钠溶液保存在用磨砂玻璃塞的玻璃试剂瓶中 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 配置一定物质的量浓度溶液时,不慎将少量水加过刻度线,应重新配置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于稀盐酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 少量的金属铜加入到FeCl3溶液中:Fe3++Cu═Fe2++Cu2+ | |
| C. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | 将少量NaOH溶液与足量Ba(HCO3)2溶液混合:Ba2++2HCO3-+2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
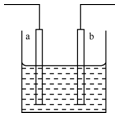
| A. | a,b可能是同种材料的电极 | |
| B. | 该装置可能是电解池,电解质溶液为稀硝酸 | |
| C. | 该装置可能是原电池,电解质溶液为稀盐酸 | |
| D. | 该装置可看作是铜一锌原电池,电解质溶液是稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8-m-n | B. | a-8+m-n | C. | a+18-m-n | D. | a+24-m-n |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
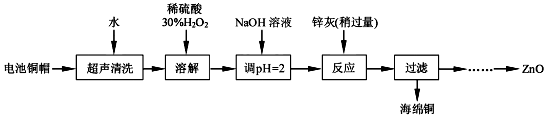
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com