
| A. | 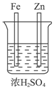 | B. | 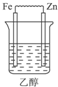 | C. | 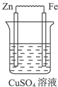 | D. | 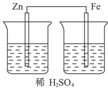 |
分析 构成原电池需具备以下条件:两个活性不同的电极;电解质溶液;形成闭合回路;存在能自动发生的氧化还原反应,且为放热反应,以此来解答.
解答 解:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,原电池中正极上发生还原反应,负极上发生氧化反应.
A.没有形成闭合回路,不能构成原电池,故A错误;
B.酒精是非电解质,不能构成原电池,故B错误;
C.符合条件,能构成原电池,故C正确;
D.没有形成闭合回路,不能构成原电池,故D错误;
故选C.
点评 本题考查了原电池原理的分析应用,该题是高考中的常见考点,属于基础性试题的考查,难度不大.明确原电池的工作原理、构成条件是答题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
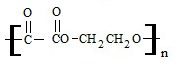 +(2n-1)H2O
+(2n-1)H2O
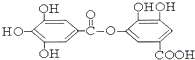 与NaOH的反应
与NaOH的反应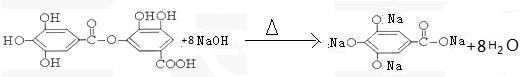
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
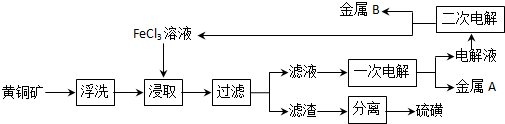
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
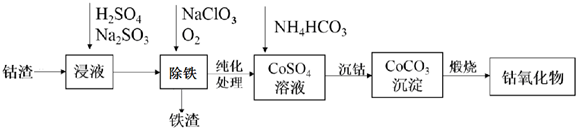
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的晶体,一定是原子晶体 | |
| B. | 离子晶体中,一定存在金属元素和非金属元素 | |
| C. | 同时含有离子键和共价键的化合物,既可能是离子化合物,也可能是共价化合物 | |
| D. | 在共价化合物中一定存在共价键,但含有共价键的不一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③ | B. | ③>①>② | C. | ③>②>① | D. | ②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的总物质的量 | ||
| C. | 混合气体的平均相对分子质量 | D. | v(B)=3V(D) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
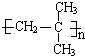 _.
_.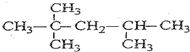 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com