
科目:高中化学 来源: 题型:推断题
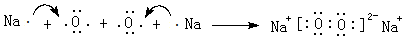 ,工业冶炼单质E的化学方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
,工业冶炼单质E的化学方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32 g 氧气所含的原子数为NA | |
| B. | 1.8 g NH4+中含有的质子数NA | |
| C. | 常温常压下,48 g O3含有的氧原子数为3NA | |
| D. | 2.4 g 金属镁变为镁离子时失去的电子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
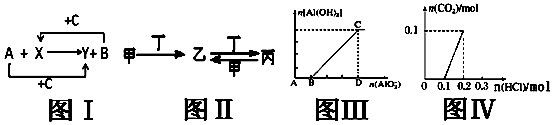
| A. | 关于图Ⅰ,已知C是氧气,X、Y是化合物,则A是钠,B是氢气 | |
| B. | 关于图Ⅱ,已知甲、乙、丙均含有相同的某种元素,若甲为NaOH溶液,则丁可能是CO2 | |
| C. | 关于图Ⅲ,表示NaAlO2溶液逐滴加入到NaOH溶液中,n(Al(OH)3)和n(AlO2-)之间的关系图象 | |
| D. | 关于图Ⅳ,表示各含0.1mol苏打和NaOH混合液中逐滴加入含溶质0.2mol的盐酸的关系图象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
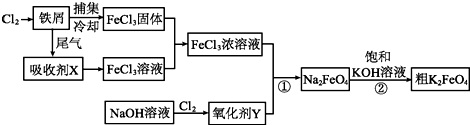
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
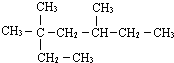 的系统命名法的名称3,3,5,-三甲基庚烷
的系统命名法的名称3,3,5,-三甲基庚烷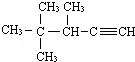 的系统命名法的名称为3,4,4-三甲基-1-戊炔.
的系统命名法的名称为3,4,4-三甲基-1-戊炔. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可利用油脂水解制备甘油 | |
| B. | 食用油反复加热会产生芳香族化合物等有害物质 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 糖、油脂、蛋白质都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
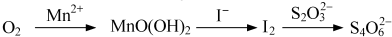
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com