
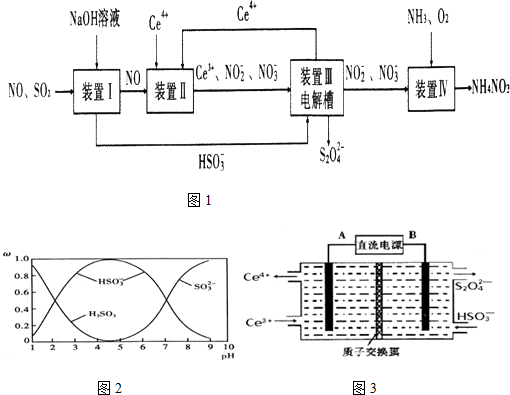
分析 装置Ⅰ中SO2是酸性氧化物,和NaOH溶液发生反应:SO2+OH-=HSO3-,NO和NaOH溶液不反应;
装置Ⅱ中NO在酸性条件下,NO和Ce4+发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
装置Ⅲ中,在电解槽的阳极Ce3+-e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,
装置Ⅳ中通入氨气、氧气,2NO2-+O2+2H++2NH3=2NH4++2NO3-,
(1)取装置Ⅰ中的吸收液vmL,I中含有HSO3-,HSO3-能将酸性高锰酸钾溶液还原而使酸性高锰酸钾溶液褪色;
(2)装置Ⅱ中NO在酸性条件下生成NO2-,Ce4+被还原生成Ce3+;
(3)A.pH=2的溶液中粒子有OH-、HSO3-、H2SO3、H2O、Na+、H+,pH=9时的溶液中所含粒子有OH-、SO32-、H2O、Na+、H+;
B.H2SO3的第二级电离平衡常数=$\frac{c({H}^{+}).c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$;
C.溶液的pH控制在4~5时,c(HSO3- )浓度最大;
D.溶液中存在电荷守恒,根据电荷守恒判断;
(4)①右边电极上HSO3-得电子生成S2O42-,发生还原反应,为阴极,连接阴极的电源电极是负极;
②根据图知,左边电极是阳极,阳极上Ce 3+失电子生成Ce 4+.
解答 解:装置Ⅰ中SO2是酸性氧化物,和NaOH溶液发生反应:SO2+OH-=HSO3-,NO和NaOH溶液不反应;
装置Ⅱ中NO在酸性条件下,NO和Ce4+发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
装置Ⅲ中,在电解槽的阳极Ce3+-e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,
装置Ⅳ中通入氨气、氧气,2NO2-+O2+2H++2NH3=2NH4++2NO3-,
(1)取装置Ⅰ中的吸收液vmL,I中含有HSO3-,HSO3-能将酸性高锰酸钾溶液还原而使酸性高锰酸钾溶液褪色,该实验滴定终点现象是滴入最后一滴溶液变为紫红色,且半分钟不变色,故答案为:滴入最后一滴溶液变为紫红色,且半分钟不变色;
(2)装置Ⅱ中NO在酸性条件下生成NO2-,Ce4+被还原生成Ce3+,离子方程式为NO+Ce4++H2O=Ce3++NO2-+2H+,
故答案为:NO+Ce4++H2O=Ce3++NO2-+2H+;
(3)A.pH=2的溶液中粒子有OH-、HSO3-、H2SO3、H2O、Na+、H+,pH=9时的溶液中所含粒子有OH-、SO32-、H2O、Na+、H+,所以所含粒子种类不同,故A正确;
B.H2SO3的第二级电离平衡常数=$\frac{c({H}^{+}).c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$,pH=7时,pH=7时,c(HSO3- )=c(SO32- ),由Ka的表达式可知,H2SO3的第二级电离平衡常数K2≈c(H+)=10-7,故B正确;
C.溶液的pH控制在4~5时,c(HSO3- )浓度最大,则为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故C正确;
D.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),所以c( Na+)>c (HSO3-)+c(SO32-),故D错误;
故选D;
(4)①右边电极上HSO3-得电子生成S2O42-,发生还原反应,为阴极,连接阴极的电源电极是负极,所以B是负极,故答案为:负;
②根据图知,左边电极是阳极,阳极上Ce 3+失电子生成Ce 4+,电极反应式为Ce3+-e-═Ce4+,
故答案为:Ce3+-e-═Ce4+.
点评 本题考查物质制备,为高频考点,涉及电解原理、盐类水解、滴定实验等知识点,明确化学反应原理、元素化合物性质是解本题关键,会正确分析流程图中发生的反应、图2溶液中存在的微粒及其性质,注意电荷守恒和物料守恒的正确运用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 摩尔是用来描述微观粒子的物理量 | |
| B. | 1 mol任何物质都含有Na个原子 | |
| C. | 0.5 mol H2O中含有的原子数目为1.5Na | |
| D. | 64g氧相当于2mol氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | 加碘食盐中所加的“碘”一般是碘化钾或碘单质 | |
| C. | 区别氯化铁溶液和氢氧化铁胶体可以用丁达尔效应 | |
| D. | 用干燥的有色布条可以检验氯化氢气体中是否混有氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
| A. | 4s时,c(B)为0.76 mol•L-1 | |
| B. | 830℃到平衡时,A的转化率为80% | |
| C. | 达平衡时,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 医疗上用的“钡餐”其成分是碳酸钡,漂白粉的成分为次氯酸钙 | |
| D. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com