
分析 (1)氢氧化钡溶液能够与二氧化碳反应生成碳酸钡沉淀,据此判断沉淀成分;
(2)①依据配制溶液体积选择容量瓶规格;
②根据滴定数据及氢氧化钡与盐酸的反应关系式计算出样品中氢氧化钡的质量分数;
(3)滴定管在装入待装液之前必须润洗;根据滴定管的正确读数方法解答;滴定结束前溶液为黄色,滴定结束时溶液为橙色,据此判断滴定终点.
解答 解:(1)Ba(OH)2能与空气中的二氧化碳反应,生成难溶于水的BaCO3,所以猜测难溶物可能为碳酸钡;
故答案为:BaCO3;Ba(OH)2能与空气中的CO2反应,生成难溶于水的BaCO3;
(2)①配制250mL约0.1mol/L Ba(OH)2溶液,需要使用250mL容量瓶,
故答案为:250 mL容量瓶;
②准确量取25.00mL所配制Ba(OH)2溶液于锥形瓶中,滴加2滴甲基橙,将0.200mol/L标准盐酸装入滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐24.20mL;根据反应关系式Ba(OH)2~2HCl,25mL氢氧化钡溶液中含有氢氧化钡的物质的量为:n[Ba(OH)2]=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.200mol/L×0.0242L=0.00242mol,氢氧化钡溶液的浓度为:c(Ba(OH)2)=$\frac{0.00242mol}{0.025L}$=0.0968mol/L,该样品中Ba(OH)2的质量分数为:$\frac{171g/mol×0.0968mol/L×0.25L}{5.000g}$=0.83;
故答案为:82.8%;
(3)滴定中,滴定管在注入标准盐酸之前,先用蒸馏水洗净,再用标准液盐酸进行润洗2-3次,避免标准液被蒸馏水稀释,影响测定结果;在滴定中,准确读数应该是滴定管上蓝线的粗细交界点对应的刻度线;滴定结束前溶液为碱性,所以溶液显示黄色,滴定结束时溶液变成橙色,所以滴定终点为:溶液由黄色变为橙色,且半分钟内保持不变;
故答案为:标准盐酸溶液润洗2~3次;粗细交界点;溶液由黄色变为橙色,且半分钟内保持不变.
点评 本题考查了中和滴定操作方法、配制一定物质的量浓度的溶液方法,明确滴定实验、配制一定物质的量浓度溶液的原理是解题关键,题目难度不大.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
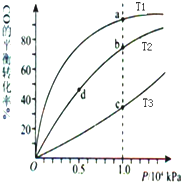
| A. | 温度:T1>T2>T3 | B. | 平衡常数:K(a)>K(c) K(b)=K(d) | ||
| C. | 正反应速率:v(a)>v(c) v(b)>v(d) | D. | 平均摩尔质量:M(a)<M(c) M(b)>M(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法分离溶液和胶体 | |
| B. | 用四氯化碳萃取碘水中的碘 | |
| C. | 用蒸馏的方法将自来水制成蒸馏水 | |
| D. | 用加热的方法分离氯化钠和单质碘固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中共消耗1.75 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为1:4 | ||
| C. | 反应中共消耗65 g Zn | D. | 反应中共转移3.6 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 通空气时,铜被腐蚀,表面产生CuO | |
| B. | 放电时,Li+透过固体电解质向Cu极移动 | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e-═2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+28.7 kJ/mol | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-28.7 kJ/mol | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ/mol | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| B. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 硝酸铵固体的溶解过程与焓变有关 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用纤维素的水解产物制取乙醇 | |
| B. | 己烷(C6H14)有四种同分异构体 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
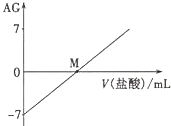 溶液的酸碱性可用酸度(AG)表示,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.室温下,将0.01mol•L-l盐酸逐滴滴人20.00mL 0.01 mol•L-l氨水中,溶液的AG变化如图所示.下列说法正确的是( )
溶液的酸碱性可用酸度(AG)表示,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.室温下,将0.01mol•L-l盐酸逐滴滴人20.00mL 0.01 mol•L-l氨水中,溶液的AG变化如图所示.下列说法正确的是( )| A. | 室温下,0.01 mol•L-l盐酸的AG=12 | B. | M点时溶液中:c(NH4+)=c(Cl-) | ||
| C. | M点加入盐酸的体积大于20.00 mL | D. | M点以后NH4+的水解程度逐渐增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com