
| A. | BF3 | B. | BeCl2 | C. | PC13 | D. | SO3 |
分析 对于共价化合物来说,元素化合价绝对值+元素原子的最外层电子数=8,则该元素原子满足8电子结构,否则不能满足8电子结构,据此进行判断.
解答 解:A.BF3中,B原子的族序数+成键数=3+3=6,所以不满足所有原子最外层为8电子结构,故A错误;
B.BeCl2分子中,Be原子的最外层电子数为:2+2=4,不满足8电子稳定结构,故B错误;
C.PCl3中,P原子的最外层电子为:5+3=8,Cl原子的最外层电子为:7+|-1|=8,都满足8电子稳定结构,故C正确;
D.SO3中,S原子的最外层电子为:6+6=12,不满足8电子稳定结构,故D错误;
故选C.
点评 本题考查原子核外电子排布,侧重考查8电子结构的判断,题目难度不大,明确元素原子最外层电子数=化合价绝对值+元素原子的最外层电子数为解答关键,试题培养了学生的分析能力及灵活应用能力.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.02 | 20.00 | 18.80 | 19.98 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
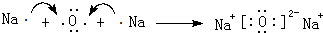 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | O2 | C. | Cl2 | D. | 产生于阴极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡前,随着反应的进行,容器内压强变小 | |
| B. | 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小 | |
| C. | 平衡时,其他条件不变,升高温度平衡常数增大 | |
| D. | 其他条件不变,使用不同催化剂,HCl(g)的转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 有机酸X的数目 | 醇Y的数目 |
| A | 4种 | 3种 |
| B | 4种 | 2种 |
| C | 5种 | 3种 |
| D | 5种 | 2种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
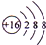
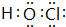
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com