
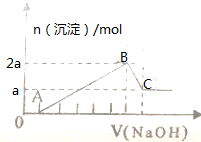
 100mL某无色溶液由H+、Na+、Mg2+、Al3+、Fe3+、CO32-、Cl-等离子中的几种混合组成(不考虑水电离出的离子),向溶液中逐滴加0.5mol/L氢氧化钠溶液直到过量,产生沉淀的情况如图所示.
100mL某无色溶液由H+、Na+、Mg2+、Al3+、Fe3+、CO32-、Cl-等离子中的几种混合组成(不考虑水电离出的离子),向溶液中逐滴加0.5mol/L氢氧化钠溶液直到过量,产生沉淀的情况如图所示.| 0.3mol |
| 0.1L |


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| O3/Zn+H2O |

 反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论:
反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在有机溶剂中的溶解能力较Cu2+小 |
| B、当吸入氯气等有毒气体,可吸入少量酒精或乙醚的混合蒸气解毒;氨气和溴中毒时要立即进行人工呼吸 |
| C、易燃试剂与强氧化性试剂需分开放置,并远离火源;金属着火时,可用细沙覆盖火 |
| D、在适量氯化钴的乙醇溶液中,逐滴加入水至溶液恰好呈粉红色,加热该溶液,结果依次呈现紫色、蓝紫色、蓝色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用溴水可鉴别苯、CCl4、己烯 |
| B、加浓溴水,然后过滤可除去苯中少量己烯 |
| C、苯、溴水、铁粉混合制成溴苯 |
| D、可用分液漏斗分离己烷和苯的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com