
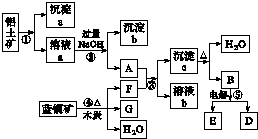
分析 铝土矿的主要成分是Al2O3、Fe2O3、SiO2,溶液a能与氢氧化钠溶液反应,应含有铝离子、铁离子,则铝土矿加入盐酸,溶解过滤得到沉淀a为SiO2,溶液a为氯化铝、氯化铁溶液,加入过量氢氧化钠溶液,过滤得到沉淀b为Fe(OH)3,A为NaAlO2溶液,蓝铜矿的主要成分是2CuCO3•Cu(OH)2,受热易分解加入木炭还原生成产物为F为CO2,G为Cu,F+A反应生成沉淀c为Al(OH)3,溶液b为碳酸氢钠溶液,沉淀c受热分解得到B为Al2O3和水,氧化铝电解得到E和D为氧气和铝,以此解答该题.
解答 解:铝土矿的主要成分是Al2O3、Fe2O3、SiO2,溶液a能与氢氧化钠溶液反应,应含有铝离子、铁离子,则铝土矿加入盐酸,溶解过滤得到沉淀a为SiO2,溶液a为氯化铝、氯化铁溶液,加入过量氢氧化钠溶液,过滤得到沉淀b为Fe(OH)3,A为NaAlO2溶液,蓝铜矿的主要成分是2CuCO3•Cu(OH)2,受热易分解加入木炭还原生成产物为F为CO2,G为Cu,F+A反应生成沉淀c为Al(OH)3,溶液b为碳酸氢钠溶液,沉淀c受热分解得到B为Al2O3和水,氧化铝电解得到E和D为氧气和铝,
(1)反应②是氢氧化钠溶液和氯化铝溶液反应生成偏铝酸钠,反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,氢氧化钠溶液和氯化铁反应生成氢氧化铁沉淀,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,
故答案为:Al3++4OH-=AlO2-+2H2O、Fe3++3OH-=Fe(OH)3↓;
(2)上述分析可知a为二氧化硅化学式为SiO2,c为氢氧化铝化学式为Al(OH)3,
故答案为:SiO2;Al(OH)3;
(3)洗涤沉淀c的实验操作方法是:在漏斗内的沉淀上加入一定量的蒸馏水,没过沉淀,待水自然流下,重复数次,
故答案为:在漏斗内的沉淀上加入一定量的蒸馏水,没过沉淀,待水自然流下,重复数次;
(4)电解熔融氧化铝得到铝和氧气反应的化学方程式为:2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,
故答案为:2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
点评 本题考查了物质分离提纯方法和过程分析判断,为高考常见题型,侧重于学生的分析能力和实验能力的考查,题目主要是铝及其化合物的性质、反应现象、反应产物、分离混合物的试剂选择等知识点,注意把握物质的性质,题目难度中等.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
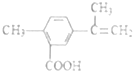
| A. | 在一定条件下,能发生取代、氧化、酯化和加聚反应 | |
| B. | 该物质分子中最多可以有11个碳原子在同一平面上 | |
| C. | 1mol该物质最多可与4molH2发生加成反应 | |
| D. | 1mol该物质完全氧化最多可消耗14mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁制容器盛放硫酸铜溶液,容器易被腐蚀 | |
| B. | 利用催化措施,可以将汽车尾气中的CO和NO转化为无害气体 | |
| C. | 防止酸雨发生的重要措施之一是使用清洁能源 | |
| D. | 氧化铜呈红色,可作为制造陶瓷的红色颜料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
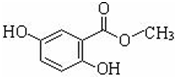 龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
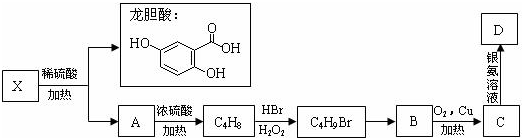
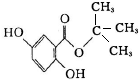

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
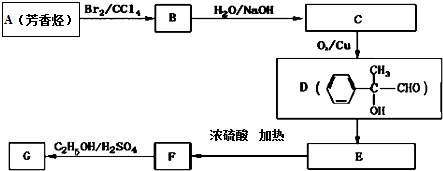
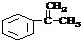 .
.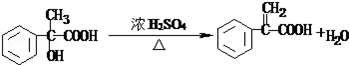 .
.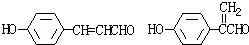 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{4}$He原子核内含有4个质子 | B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | ||
| C. | ${\;}_{2}^{3}$He原子核内含有3 个中子 | D. | ${\;}_{2}^{4}$He具有较强的金属性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com