
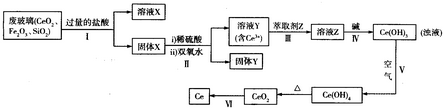
| 3 |
| ||
| 3 |
| ||
| 3 |
| ||


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
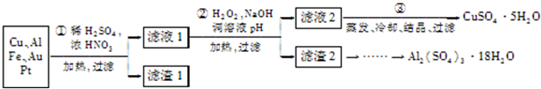
| 沉淀物 | Fe( OH)2 | Fe( OH)3 | Al( OH)3 | Cu( OH)2 |
| 开始沉淀 | 5.8 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 8.8 | 3.2 | 5.2 | 6.7 |
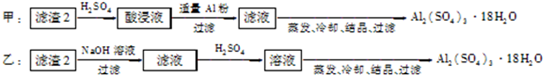
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.6mol |
| B、1.8mol |
| C、2.2mol |
| D、2.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
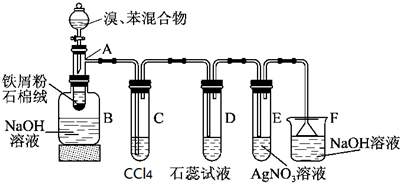
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 分散到水中 | 得悬浊液 | 得无色溶液 | 液体分层,且下层为无色油状液体 | 得无色溶液 |
| 熔点(℃) | 1452 | -21.3 | -11.5 | 801 |
| 沸点(℃) | 1703 | 78.9 | 117 | 1210 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学对实验室用石灰石和稀盐酸制取二氧化碳后的溶液进行成分鉴定,取废液的上层清液,开始出现气泡,滴加至10g才开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测的沉淀的质量为5g,并绘制出下列图象.
某同学对实验室用石灰石和稀盐酸制取二氧化碳后的溶液进行成分鉴定,取废液的上层清液,开始出现气泡,滴加至10g才开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测的沉淀的质量为5g,并绘制出下列图象.查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O |
| B、放电时负极附近溶液的pH不变 |
| C、放电时电解质溶液中的OH-向正极移动 |
| D、充电时Cd与外电源的正极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com