


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl-、Br-、I- |
| B、Br-、Cl-、I- |
| C、I-、Br-、Cl- |
| D、Br-、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PH<7 |
| B、PH=7 |
| C、PH>7 |
| D、上述三种均有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、已知常温下,物质的量浓度相等的CH3COONa与CH3COOH混合液的pH<7,在此溶液中继续加CH3COONa至pH=7,测得此时c(Na+ )=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| B、0.01 mol?L-1的Na2HPO4溶液中存在如下的平衡:HPO42-+H2O?H2PO4-+OH- HPO42-?H++PO43- 且溶液pH>7;加水稀释后溶液中HPO42-、PO43-、H+的浓度均减小 |
| C、图中,Y轴S表示相应金属氢氧化物在饱和溶液中阳离子的浓度,由图中数据可计算出室温下Ksp[Cu(OH)2]=1.0×10-12 |
| D、由图可知,若Fe(NO3)3溶液中含有少量的Co2+杂质,可通过加入Fe(OH)3的方法来除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
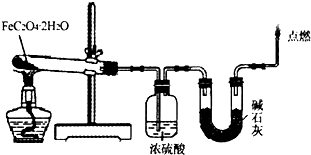 (1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题
(1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com