
分析 依据ω=$\frac{溶质的质量}{溶液的质量}$;c=$\frac{n}{V}$;
质量浓度:单位体积混合物中某组分的质量;
摩尔数为:物质的物质的量;
质量摩尔浓度为:溶液中某溶质的物质的量除以溶剂的质量质量;
解答 解:将0.9gNaCl溶于1L纯净水中配成溶液,溶液的体积约为1L;
溶液的质量分数为:$\frac{0.9g}{(0.9+1000)g}$×100%=0.89%;
质量浓度:$\frac{0.9g}{1L}$=0.9g/L;
物质的量浓度:$\frac{\frac{0.9g}{58.5g/mol}}{1L}$=0.0154mol/L;
溶质的摩尔数:$\frac{0.9g}{58.5g/mol}$=0.0154mol;
质量摩尔浓度:$\frac{0.0154mol}{1Kg}$=0.0154mol/Kg;
答:该溶液的质量分数为0.89%、质量浓度0.9g/L、物质的量浓度0.0154mol/L、摩尔数0.0154mol、质量摩尔浓度0.0154mol/Kg.
点评 本题考查了溶液浓度的有关计算,明确相关浓度定义是解题关键,题目难度不大.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 溶液 | 操作 | 现象 |
| A | 滴有酚酞的明矾溶液 | 加热 | 颜色变深 |
| B | 滴有酚酞的氨水 | 加入少量NH4Cl固体 | 颜色变浅 |
| C | 滴有酚酞的CH3COONa溶液 | 加入少量NH4NO3固体 | 颜色变浅 |
| D | 氯化铁溶液 | 加热 | 颜色变浅 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL | B. | 250mL | C. | 100mL | D. | 1000mL | ||||
| E. | 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B | 用铂丝蘸取少量某溶液进行焰色反应,若火焰呈黄色 | 原溶液一定有Na+,一定无K+ |
| C | NaI溶液$\stackrel{30%H_{2}O_{2}}{→}$$\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | 酸性条件下H2O2的氧化性比I2强 |
| D | 将乙醇与浓硫酸共热至170℃,所得气体通入酸性高锰酸钾溶液中,溶液褪色 | 说明乙醇发生消去反应生成乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中加少量氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH${\;}_{4}^{+}$+H++SO${\;}_{4}^{2-}$═BaSO4↓+NH3•H2O+H2O | |
| C. | 惰性电极电解饱和NaCl溶液:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2 | |
| D. | 向Na2SO3溶液中滴加足量NaClO溶液:SO${\;}_{3}^{2-}$+ClO-═SO${\;}_{4}^{2-}$+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
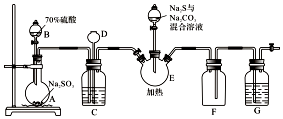 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:| 实验方案 | 现象 | 结论 |
| ①取少量溶液于小试管中,滴加足量BaCl2溶液 | 有白色沉淀生成 | 产品中一定含有杂质 |
| ②将①所得混合液过滤,向洗涤后的沉淀滴加过量稀盐酸,加热,并用湿润的品红试纸置于管口 | 仍有白色沉淀 | 产品中含Na2SO4 |
| 品红试纸不褪色 | 产品中不含Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
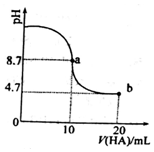 室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如闬所示.下列说法正确的是( )
室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如闬所示.下列说法正确的是( )| A. | a 点所示溶液中 c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b 两点所示溶液中水的电离程度相问 | |
| C. | b点所示溶液中c(A-)>c(HA) | |
| D. | pH=7时,c(Na+)-=c(A-)+c(HA) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com