
【题目】碳酸钙是一种用途非常广泛的产品,可用于生成硫酸、漂白粉等一系列物质(如图).下列说法正确的是( ) 
A.CO,SO2均为无色有刺激性气味的有毒气体
B.工业上利用Cl2 和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
科目:高中化学 来源: 题型:
【题目】2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念.
(1)广州亚运会火炬“潮流”采用了丙烷(C3H8)作为燃料,燃烧后的产物为水和二氧化碳.在298K时,1mol丙烷完全燃烧生成CO2和液态水放出2221.5kJ的热量,则该反应的热化学方程式为 .
(2)广州是一座美丽的海滨城市,海水资源非常丰富.
①海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O═4A1(OH)3 , 下列说法正确的是(填写序号字母);
a.电池工作时,电流由铝电极沿导线流向铂电极
b.铂电极采用网状比块状更利于O2放电
c.海水中的OH﹣向铝电极方向移动
②用惰性电极电解200mLl.5molL﹣1食盐水;电解2min时,两极共收集到448mL气体(标准状况下).写出该电解反应的离子方程式
假设电解前后溶液的体积不变,则电解后该溶液的pH为 .
(3)将CO和H2液化作为民用燃料,便于运输和储存.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)CH3OH(g)达到化学平衡状态. 
①该反应的平衡常数表达式K=;根据如图,升高温度,K值将;增大压强K值将(填“增大”、“减小”或“不变”).
②500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是(用nA、nB、tA、tB表示).
③判断该可逆反应达到化学平衡状态的标志是(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
④300℃时,将容器的容积压缩到原来的 ![]() ,在其他条件不变的情况下,对平衡体系产生的影响是(填字母).
,在其他条件不变的情况下,对平衡体系产生的影响是(填字母).
a.c(H2)减少 b正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时 ![]() 减小.
减小.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 摩尔质量就等于物质的相对分子质量或相对原子质量
B. 摩尔质量就是物质的相对分子质量或相对原子质量的6.02×1023倍
C. HNO3的摩尔质量是63g
D. H2SO4和H3PO4的摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.石油分馏时温度计水银球位置处在蒸馏烧瓶的支管口附近
B.在葡萄糖溶液中加入硫酸铜溶液,加热,可观察到砖红色沉淀
C.在乙醇中加入钠可产生氢气
D.浓HNO3应保存在棕色试剂瓶中,并贮存在避光、低温处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对化学反应限度的叙述,错误的是
A. 任何可逆反应都有一定的限度B. 化学反应达到限度时,正逆反应速率相等
C. 化学反应的限度是不可改变的D. 化学反应的限度与时间的长短无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代无机化学对硫﹣氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫﹣氮化合物的分子结构.下列说法正确的是( ) 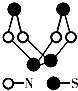
A.该物质的分子式为SN
B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A.常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO﹣)>c(Na+)
B.1 molL﹣1的硫化钠溶液中,c(H+)+c(Na+)=c(OH﹣)+c(HS﹣)+c(S2﹣)
C.稀释醋酸溶液,溶液中所有离子的浓度均降低
D.pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
(1)Cu2+基态的电子排布式可表示为;
(2)SO42﹣的空间构型为(用文字描述);中心原子采用的轨道杂化方式是;写出一种与SO42﹣互为等电子体的分子的化学式:;
(3)向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4]2﹣ . 不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 .
(5)CuS比CuO的熔点(填高或低),原因是 .
(6)闪锌矿的主要成分ZnS,晶体结构如图所示,其晶胞边长为540.0pm,密度为(列式并计算),a位置S2﹣离子与b位置Zn2+离化学﹣选修5:有机化学基础子之间的距离为pm(列式表示). 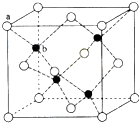
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com